题目内容
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
【答案】还原性(还原剂) Cu 2:3 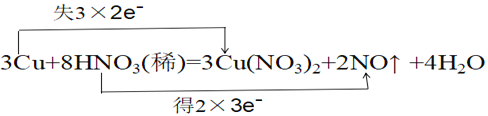 1.12L
1.12L
【解析】
(1)服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收,反应中铁元素化合价降低,得到电子,作氧化剂,因此维生素C失去电子,即这句话说明维生素C在这一反应中起的作用是还原性(还原剂)。
(2)①反应中铜元素化合价从0价升高到+2价,失去2个电子,则该反应中还原剂为Cu;
②氮元素化合价从+5价降低到+2价得到3个电子,硝酸是氧化剂,根据电子得失守恒可知氧化剂与还原剂之比是2:3;
③根据以上分析可知反应中转移6个电子,则用双线桥标出该反应转移电子数目情况为 ;
;
④每产生1molNO转移3mol电子,如反应中转移了0.15mol电子,则产生的NO的物质的量是0.15mol÷3=0.05mol,NO气体在标准状况下体积为0.05mol×22.4L/mol=1.12L。

练习册系列答案
相关题目