题目内容
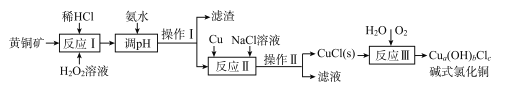
【题目】我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
已知:I.a、b、c均为整数
II.![]()
(1)CuFeS2中S的化合价为____。
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为___ ;H2O2优于HNO3的原因是____。
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中![]() _____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
_____(填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____。
(4)操作I和操作Ⅱ与生活中的下列操作____具有相似的化学原理。
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为____;反应Ⅲ的化学反应方程式为____________
【答案】 -2 17:2 HNO3的还原产物污染环境,或双氧水还原产物是水不引入杂质 变大 c(NH4+)=c(Cl-)>c(OH-)=c(H+) A NaCl过多CuCl会生成CuCl22-溶解损失 Cu2(OH)3Cl 4CuCl+4H2O+O2=2Cu2(OH)3Cl+2HCl
【解析】(1) CuFeS2中S的化合价为-2价;(2)实验测得反应I中有SO42-生成,2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O,该反应中氧化剂与还原剂的物质的量之比为 17:2 ;H2O2优于HNO3的原因是HNO3的还原产物污染环境,或双氧水还原产物是水不引入杂质;(3)已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,氨根离子浓度变大,酸性增强,氢氧根离子浓度变小,该过程中![]() 变大;若最后所得溶液呈中性,根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则该体系中离子浓度的大小顺序是c(NH4+)=c(Cl-)>c(OH-)=c(H+);(4)操作I和操作Ⅱ为过滤,与生活中的下列操作用淘米筛沥水具有相似的化学原理,故选A。(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是NaCl过多CuCl会生成CuCl22-溶解损失;(6)n(Cl-)=n(AgCl)×100.00mL/25.00mL=1.435 g/143.5g·mol-1×100.00mL/25.00mL=4.000×10-2mol,n(Cu2+)=n(EDTA)×100.00mL/25.00mL=0.4000 mol·L-1×50.00 mL×10-3 L·mL-1×100.00mL/25.00mL=8.000×10-2 mol,n(OH-)=2n(Cu2+)-n(Cl-)=2×8.000×10-2mol-4.000×10-2 mol=1.2×10-2 mol,n(Cu2+):n(OH-):n(Cl-):n(H2O)=2:3:1:即化学式为Cu2(OH)3Cl;反应Ⅲ的化学反应方程式为4CuCl+4H2O+O2=2Cu2(OH)3Cl+2HCl。
变大;若最后所得溶液呈中性,根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则该体系中离子浓度的大小顺序是c(NH4+)=c(Cl-)>c(OH-)=c(H+);(4)操作I和操作Ⅱ为过滤,与生活中的下列操作用淘米筛沥水具有相似的化学原理,故选A。(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是NaCl过多CuCl会生成CuCl22-溶解损失;(6)n(Cl-)=n(AgCl)×100.00mL/25.00mL=1.435 g/143.5g·mol-1×100.00mL/25.00mL=4.000×10-2mol,n(Cu2+)=n(EDTA)×100.00mL/25.00mL=0.4000 mol·L-1×50.00 mL×10-3 L·mL-1×100.00mL/25.00mL=8.000×10-2 mol,n(OH-)=2n(Cu2+)-n(Cl-)=2×8.000×10-2mol-4.000×10-2 mol=1.2×10-2 mol,n(Cu2+):n(OH-):n(Cl-):n(H2O)=2:3:1:即化学式为Cu2(OH)3Cl;反应Ⅲ的化学反应方程式为4CuCl+4H2O+O2=2Cu2(OH)3Cl+2HCl。