题目内容
【题目】工业上以硫酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,流程如图:
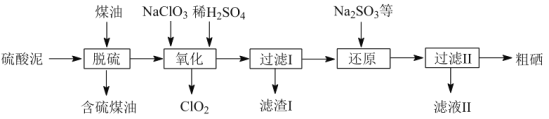
(1)“脱硫”过程中,温度控制在95℃,原因是___。
(2)“氧化”过程中,Se转化成H2SeO3,该反应的化学方程式为___。
(3)“还原”过程是通过控制电位还原的方法将电位高的物质先还原,电位低的物质保留在溶液中。下表是将“过滤Ⅰ”所得滤液中所含物质还原对应的电位。控制电位在0.782~1.692V,可除去“过滤Ⅰ”所得滤液中残留的ClO2。
名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
电位/V | 0.435 | -0.885 | -0.463 | 0.782 | 1.692 | 0.743 |
为使硒和杂质金属分离,加入Na2SO3还原时,电位应控制在___范围;H2SeO3(弱酸)还原为硒的离子反应方程式为___。
(4)滤液Ⅱ中主要存在的金属阳离子有Zn2+、Na+、___。
(5)所得粗硒需精制。向粗硒浸出液中加入Na2S溶液可以将残留的Fe2+等微量杂质离子转化为沉淀而除去。已知25℃时Ksp(FeS)=6.0×10-18,要使溶液中Fe2+沉淀完全[c(Fe2+)≤1.0×10-5mol·L-1],则需控制溶液中c(S2-)≥___mol·L-1。
【答案】温度低于95℃,脱硫速率偏低(硫在煤油中溶解度降低),温度高于95℃,煤油挥发量加大 4NaClO3+Se+2H2SO4=2Na2SO4+4ClO2↑+H2O+H2SeO3 0.435~0.743 H2SeO3+2SO32-=2SO42-+Se↓+H2O Fe2+、Cu2+ 6.0×10-13
【解析】
硫酸泥中加煤油,将S溶解、过滤以滤液的形式除去,滤渣中的Se用NaClO3氧化成H2SeO3,同时Fe2O3、CuO、ZnO被硫酸溶解,过滤除去SiO2,溶液中主要含有Fe3+、Cu2+、Zn2+、H2SeO3、Na+、SO42-,用Na2SO3还原,H2SeO3被还原成Se,Fe3+被还原成Fe2+,将电位控制在0.435~0.743,然后过滤使Cu2+、Zn2+、Fe2+、Na+、SO42+以滤液Ⅱ形式除去,得到粗Se。
(1)S溶于煤油,Se、Fe2O3、CuO、ZnO、SiO2等不溶于煤油,过滤可除去S和煤油,温度太低,S在煤油中的溶解度太小,脱硫率低,除不尽,温度太高,煤油挥发太多,故答案为:温度低于95℃,脱硫速率偏低(硫在煤油中溶解度降低),温度高于95℃,煤油挥发量加大;
(2)Se化合价从0升高到+4,作还原剂,NaClO3做氧化剂,还原产物为ClO2,Cl化合价从+5降低到+4,根据得失电子守恒可知,氧化剂和还原剂物质的量比=4:1,再结合原子守恒可得方程式:4NaClO3+Se+2H2SO4=2Na2SO4+4ClO2↑+H2O+H2SeO3,故答案为:4NaClO3+Se+2H2SO4=2Na2SO4+4ClO2↑+H2O+H2SeO3;
(3)从表格可知,为使硒和杂质金属分离,要将电位控制在0.743以下,0.435以上,H2SeO3被还原成Se,化合价降低4,SO32-作还原剂,化合价升高2,被氧化成SO42-,氧化剂和还原剂物质的量之比=1:2,结合电荷守恒、原子守恒可得离子方程式为:H2SeO3+2SO32-=2SO42-+Se↓+H2O,故答案为:0.435~0.743;H2SeO3+2SO32-=2SO42-+Se↓+H2O;
(4)通过控制电位还原,几种金属离子均遗留在了溶液里,随滤液除去了,所以滤液Ⅱ中主要存在的金属阳离子有Zn2+、Na+、Fe2+、Cu2+,故答案为:Fe2+、Cu2+;
(5)Ksp(FeS)=c(Fe2+)×c(S2-),![]() ,当c(Fe2+)≤1.0×10-5mol·L-1时,认为完全沉淀,有
,当c(Fe2+)≤1.0×10-5mol·L-1时,认为完全沉淀,有![]() ,解得:c(S2-)≥6.0×10-13 mol·L-1,故答案为:6.0×10-13。
,解得:c(S2-)≥6.0×10-13 mol·L-1,故答案为:6.0×10-13。

 阅读快车系列答案
阅读快车系列答案