题目内容
以下是对化学反应变化过程及结果的研究。按要求回答问题:
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。

向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO2++2H++V2+ V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。

向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO2++2H++V2+
 V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。Ⅰ.(1)③②④①
(2)0.03 mol·L-1·min-1
(3)FeS CuS
Ⅱ.VO2++H2O-e-=VO2-+2H+ 1
(2)0.03 mol·L-1·min-1
(3)FeS CuS
Ⅱ.VO2++H2O-e-=VO2-+2H+ 1
Ⅰ.(1)酸越弱生成的钠盐碱性越强,所以pH由大到小的顺序为③②④①;
(2)放出热量176.94 kJ时二氧化硫参加反应的物质的量是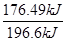 ×2 mol=1.8 mol,v(SO2)=
×2 mol=1.8 mol,v(SO2)=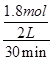 =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;
Ⅱ.充电时,阳极上失电子发生氧化反应,VO2++H2O-e-=VO2++2H+;
硫酸铜溶液中硫酸铜的物质的量是1 mol,当转移0.1 mol电子时,溶液中阳极上析出0.025 mol氧气,同时生成0.1 mol氢离子,溶液中氢离子浓度=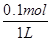 =0.1 mol·L-1,所以溶液的pH=1。
=0.1 mol·L-1,所以溶液的pH=1。
(2)放出热量176.94 kJ时二氧化硫参加反应的物质的量是
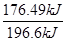 ×2 mol=1.8 mol,v(SO2)=
×2 mol=1.8 mol,v(SO2)=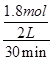 =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;Ⅱ.充电时,阳极上失电子发生氧化反应,VO2++H2O-e-=VO2++2H+;
硫酸铜溶液中硫酸铜的物质的量是1 mol,当转移0.1 mol电子时,溶液中阳极上析出0.025 mol氧气,同时生成0.1 mol氢离子,溶液中氢离子浓度=
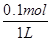 =0.1 mol·L-1,所以溶液的pH=1。
=0.1 mol·L-1,所以溶液的pH=1。
练习册系列答案
相关题目
 CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:
 CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表: 2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据: 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。 v(NH3)=v(O2)
v(NH3)=v(O2) v(O2)=v(H2O)
v(O2)=v(H2O) v(NH3)=v(H2O)
v(NH3)=v(H2O) 3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( ) PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为