题目内容
已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍
 2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH="-92.20" kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | n5 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍
C
通过反应方程式可求得:n1=1.4,n2=0.6,n3=1.0,n5=1.0,n4=3.0,n6="3.0,3" h内v(N2)=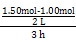 ="0.083" mol·L-1·h-1,A选项错;由上面计算数据可知3 h时已建立平衡,K=
="0.083" mol·L-1·h-1,A选项错;由上面计算数据可知3 h时已建立平衡,K=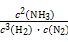 =
=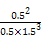 =
=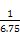 =0.148,B选项错,反应进行到1 h放出热量
=0.148,B选项错,反应进行到1 h放出热量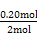 ×92.20 kJ="9.22" kJ,C选项正确,4 h时,再充入1 mol N2,平衡右移,H2转化率增大,而N2转化率降低,D选项错。
×92.20 kJ="9.22" kJ,C选项正确,4 h时,再充入1 mol N2,平衡右移,H2转化率增大,而N2转化率降低,D选项错。
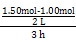 ="0.083" mol·L-1·h-1,A选项错;由上面计算数据可知3 h时已建立平衡,K=
="0.083" mol·L-1·h-1,A选项错;由上面计算数据可知3 h时已建立平衡,K=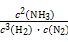 =
=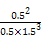 =
=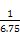 =0.148,B选项错,反应进行到1 h放出热量
=0.148,B选项错,反应进行到1 h放出热量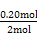 ×92.20 kJ="9.22" kJ,C选项正确,4 h时,再充入1 mol N2,平衡右移,H2转化率增大,而N2转化率降低,D选项错。
×92.20 kJ="9.22" kJ,C选项正确,4 h时,再充入1 mol N2,平衡右移,H2转化率增大,而N2转化率降低,D选项错。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求: pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( ) 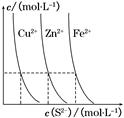
 V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。 2NH3(g)在10 L的密闭容器中进行,测得
2NH3(g)在10 L的密闭容器中进行,测得 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表: 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是