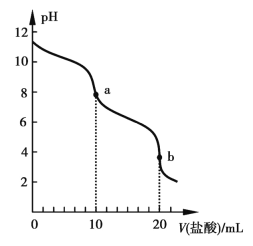
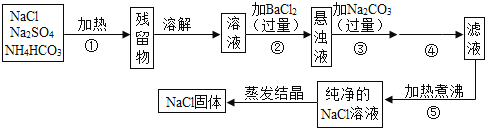
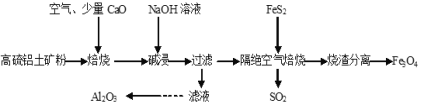
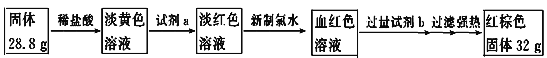
题目内容
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为___________________________。在元素周期表中,该元素在________(填“s”“p”“d”“f”或“ds”)区。与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有__________种。
②CO32-的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为___________________________________。
②CO2分子中C原子轨道的杂化类型为________________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为__________________________________。
【答案】3d54s2 d 2 平面三角形 C≡O sp 3 NA
【解析】
(1)①Mn原子核外电子数为25,基态原子的电子排布式为:1s22s22p63s23p63d54s2,价电子电子排布式可为3d54s2;在元素周期表中,该元素在d区;与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有Cr、Cu均为4s1,共2种;
②CO32-中C原子价层电子对数为3+![]() =3、没有孤对电子,其空间构型为平面三角形;
=3、没有孤对电子,其空间构型为平面三角形;
(2)①CO与N2互为等电子体,二者结构相似,CO分子中原子之间形成三键,故其结构式为C≡O;
②CO2的结构式为O=C=O,C原子形成2个σ键,没有孤对电子,杂化轨道数目为2,采取sp杂化;
③甲醛的结构式为![]() ,单键为σ键,双键含有1个σ键、1个π键,分子含有3个σ键,1 mol甲醛(HCHO)分子中所含σ键的数目为3 NA。
,单键为σ键,双键含有1个σ键、1个π键,分子含有3个σ键,1 mol甲醛(HCHO)分子中所含σ键的数目为3 NA。

【题目】二甲醚(![]() )是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① |
|
|
② |
|
|
③ |
|
|
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 |
|
| C≡O | H-O | C-H |
| 436 | p>343 | 1076 | 465 | 413 |
由上述数据计算![]() __________________________________;
__________________________________;
(2)该工艺的总反应为![]() ,该反应
,该反应![]() _______________,化学平衡常数
_______________,化学平衡常数![]() ______________________(用含
______________________(用含![]() 的代数式表示);
的代数式表示);
(3)下列措施中,能提高![]() 产率的有______________________________;
产率的有______________________________;
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了![]() 的产率,原因是___________________________。
的产率,原因是___________________________。
(5)以![]() 通入
通入![]() 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应: ![]() ,其
,其![]() 的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是____________________;
的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是____________________;
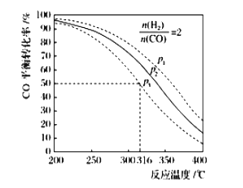
A.该反应的![]()
B.若在![]() 和
和![]() 时反应达到平衡,则CO的转化率小于50%
时反应达到平衡,则CO的转化率小于50%
C.若在![]() 和
和![]() 时反应达到平衡, 氢气的转化率等于50%
时反应达到平衡, 氢气的转化率等于50%
D.若在![]() 和
和![]() 时,起始时
时,起始时![]() ,则达平衡时CO的转化率大于50%
,则达平衡时CO的转化率大于50%
E.若在![]() 和
和![]() 时,反应达平衡后保持温度和压强不变,再充入
时,反应达平衡后保持温度和压强不变,再充入![]() 和
和![]() ,则平衡时二甲醚的体积分数增大
,则平衡时二甲醚的体积分数增大
(6)某温度下,将![]() 和
和![]() 充入容积为
充入容积为![]() 的密闭容器中,发生反应:
的密闭容器中,发生反应:![]() ,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数
,反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数![]() ____________________________。
____________________________。