题目内容
【题目】Ⅰ.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中, 采用废易拉罐(主要成分为 Al,含有少量的 Fe、Mg 杂质)制备明矾的过程如下图所示。 回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用______________(填标号)。
a.HCl 溶液 b.H2SO4 溶液 c.氨水 d.NaOH 溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_________________________。
(3)沉淀 B 的化学式为______________________
II.毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O 的流程如下:

(4)毒重石用盐酸浸取前需充分研磨,目的是_________________________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(5)滤渣Ⅱ中含 (填化学式)。加入 H2C2O4 时应避免过量,原因是_________________________________。已知:Ksp(BaC2O4) =1.6×10-7, Ksp(CaC2O4)=2.3×10-9
【答案】d 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al(OH)3 增 大 接 触 面 积 从 而 使 反 应 速 率 加 快 Mg(OH)2、Ca(OH)2H2C2O4 过量会导致生成 BaC2O4 沉淀,产品的产量减少
【解析】
本题主要考查物质的制备实验与化学工艺流程。
I.(1)由易拉罐制备明矾,则需要通过相应的操作除去Fe、Mg,根据金属单质的性质可选择强碱性溶液;
(2)根据(1)中选择的试剂写出相关化学方程式;
(3)Al在第一步反应中生成AlO2-,在第二步中加入了NH4HCO3,NH4+和HCO3-均能促进AlO2-水解生成Al(OH)3沉淀;
II.浸取过程中碳酸钡和稀盐酸反应生成氯化钡,再加入NH3·H2O调节pH至8,由表中数据可知,滤渣I为Fe(OH)3,再将滤液调节pH至12.5,由表中数据可知,滤渣II为Mg(OH)2和少量Ca(OH)2,再加入H2C2O4,可除去Ca2+,再进行后续操作制备出BaCl2·2H2O,据此分析作答。
(1)根据铝能溶解在强酸和强碱性溶液,而铁和镁只能溶解在强酸性溶液中的性质差异,可选择NaOH溶液溶解易拉罐,可除去含有的铁、镁等杂质,故选d项;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)滤液中加入NH4HCO3溶液后,电离出的NH4+和HCO3-均能促进AlO2-水解,反应式为NH4++AlO2-+2H2O=Al(OH)3![]() +NH3·H2O,生成Al(OH)3沉淀。
+NH3·H2O,生成Al(OH)3沉淀。
Ⅱ、(4)毒重石用盐酸浸取前研磨将块状固体变成粉末状,可以增大反应物的接触面积从而使反应速率加快;
(5)根据流程图和表中数据分析加入NH3·H2O调节pH至8,由表中数据可知,可除去Fe3+,滤渣I为Fe(OH)3,再将滤液调节pH至12.5,由表中数据可知,可完全除去Mg2+,部分Ca2+会沉淀,滤渣II为Mg(OH)2和少量Ca(OH)2,再加入H2C2O4,可除去Ca2+,若加入过量的H2C2O4,易发生Ba2++H2C2O4=BaC2O4![]() +2H+产生BaC2O4沉淀,导致产品的产量减少。
+2H+产生BaC2O4沉淀,导致产品的产量减少。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)![]() CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A. 反应在t1min内的平均速率为![]()
B. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】下面a~e是中学化学实验中常见的几种定量仪器:a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是________(填字母)。
(2)下列操作合理的是________(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
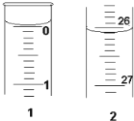
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为________mL。
(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=________ mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定



