题目内容
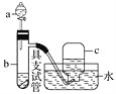
【题目】如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的简单实验装置。
Ⅰ.浓硝酸的强氧化性实验
将足量铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,往具支试管中滴入约2 mL浓硝酸,用排水法收集产生的气体。
(1)写出具支试管中发生反应的化学方程式:____,该反应中硝酸表现出的化学性质是____。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象是_____。
Ⅱ.稀硝酸的强氧化性实验
(3)在上述实验的基础上,欲进一步证明稀硝酸也具有强氧化性,可进行的简便、合理的实验操作是______。
(4)能证明稀硝酸与铜反应产生NO的实验现象是___(填字母)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应的实验,再进行铜与稀硝酸反应的实验,其优点_____。
【答案】Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O 酸性、氧化性 铜片逐渐溶解,溶液变蓝,放出红棕色气体 往分液漏斗中加水稀释浓硝酸,打开活塞,滴入稀硝酸 C 利用Cu与浓硝酸反应生成的NO2排出试管中的空气,有利于观察Cu与稀硝酸的反应产物
【解析】
(1)铜与浓硝酸反应生成硝酸铜、二氧化氮、水;该反应中有硝酸铜生成,硝酸中氮元素化合价由+5降低为+4;
(2)铜被氧化为硝酸铜,表现出硝酸的强氧化性;
(3)铜能在稀硝酸中溶解,证明稀硝酸具有强氧化性;
(4)NO2是红棕色气体,与水反应生成硝酸和NO;NO是无色气体,与氧气反应生成红棕色NO2。
(5)Cu与浓硝酸反应生成的NO2排出试管中的空气。
(1)铜与浓硝酸反应生成硝酸铜、二氧化氮、水,反应方程式是Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O;该反应中有硝酸铜生成,硝酸表现酸性,硝酸中氮元素化合价由+5降低为+4,硝酸表现氧化性;
(2)铜片逐渐溶解,溶液变蓝,放出红棕色气体,表现出浓硝酸具有强氧化性;
(3)往分液漏斗中加水稀释浓硝酸,打开活塞,滴入稀硝酸,铜能继续溶解,证明稀硝酸也具有强氧化性;
(4)A、NO2与水反应生成硝酸和NO,c中收集到无色气体,不能证明稀硝酸与铜反应产生NO,故不选A;
B、NO2与水反应生成硝酸和NO,NO与氧气反应生成红棕色NO2,c中收集到的无色气体接触空气后变为红棕色,不能证明稀硝酸与铜反应产生NO,故不选B;
C、b中产生的无色气体接触空气后变为红棕色,说明b中有NO生成,能证明稀硝酸与铜反应产生NO,故选C。
(5). 利用该装置先进行铜与浓硝酸反应的实验,再进行铜与稀硝酸反应的实验,其优点是:利用Cu与浓硝酸反应生成的NO2排出试管中的空气,有利于观察Cu与稀硝酸的反应产物。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是_________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图1所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
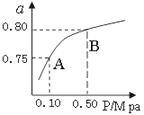
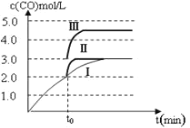
图 1 图2
(3)判断反应③△H____0; △S____0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol, 此时v(正)___v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间t变化曲线Ⅰ如上图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.常温条件下,将amol/L的CH3COOH与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________.