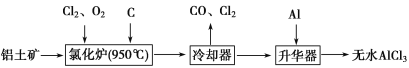
题目内容
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法正确的是
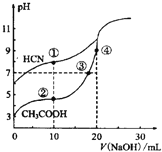
A.点①和②所示溶液中:c(CH3COO-)<c(CN-)
B.点①和②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C.点②和③所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.点③和④所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
【答案】B
【解析】
试题分析:A.点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),故A错误;B.点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN) + c(CN-) = c(CH3COOH) + c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故B正确;C.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),在③中Na元素的物质的量与醋酸的总物质的量相同,由于醋酸根离子要水解,所以c(Na+)>c(CH3COOH),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C错误;D.点③中pH=7,则c(OH-)=c(H+),则点③中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D错误;故选B。