��Ŀ����
����Ŀ������NaHCO3������Һ����ø���Һ��pH���¶ȷ������±仯
�¶�(��) | 10 | 20 | 30 | ������к���ȴ��50�� |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
��ͬѧ��Ϊ����Һ��pH���ߵ�ԭ����HCO3-��ˮ��̶���������ǿ��
��ͬѧ��Ϊ������ҺpH���ߵ�ԭ����NaHCO3���ȷֽ⣬������Na2CO3�����ƶ�Na2CO3��ˮ��̶�_________(����ڡ���С�ڡ�)NaHCO3��
��ͬѧ��Ϊ�ס��ҵ��ж϶�����֡�
��1���������ϣ�����NaHCO3�ķֽ��¶�Ϊ150�棬������_________(��ס����ҡ�)�ж��Ǵ���ġ�
��2������NaHCO3����ˮ��Һ�ı�����ȷ����_________
A��c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B��c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C��HCO3-�ĵ���̶ȴ���HCO3-��ˮ��̶�
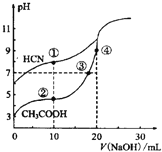
��3��ijͬѧ�ñ����ᣬ�ⶨij��Ȼ�մ�ˮ��NaHCO3��Ũ�ȣ���ⶨ��Ӧѡ���ָʾ��Ϊ ������ȡ20.00mL��Ȼ�մ�ˮ����Ӧ�� (����������)����ȡ
��4����֪0.05mol/LBa(OH)2��Һ��pHΪ11���Ҹ��¶��£�H2CO3��Ka1=4��10-7��Ka2=4��10-11����0.1mol/LNa2CO3��Һ��pH����Ϊ (�ö�����ʾ)
��5�������£�����Fe3+��CuSO4��Һ�м���Cu(OH)2��ʹFe3+ת��ΪFe(OH)3�������Ӷ���ȥFe3+���÷�Ӧ�����ӷ���ʽ�ɱ�ʾΪ ���÷�Ӧ��ƽ�ⳣ��Ϊ ��(��֪�����µ��ܶȻ�������Ksp[Cu(OH)2]=2.0��10-20,Ksp[Fe(OH)3]=4.0��10-38)��
���𰸡�
���ڣ���1���ң���2��a����3�����ȣ���ʽ����4��11-lg2.5��
��5��2Fe3++3Cu(OH)2=2Fe(OH)3+3Cu2+��K=5��1015
��������
���������̼������ǿ����������ˮ�⣬̼���Ƕ�Ԫ���ᣬ��һ������̶�ԶԶ���ڵڶ������룬����̼������ӵĵ�һ��ˮ��̶�ԶԶ���ڵڶ���ˮ��̶ȣ�����̼���Ƶ�ˮ��̶ȴ���̼�����Ƶ�ˮ��̶ȣ��ʴ�Ϊ�����ڣ�
��1��̼�����Ƶķֽ��¶���150�棬��ѹ�¼���NaHCO3��ˮ��Һ����Һ���¶ȴﲻ��150�棬����̼�����Ʋ��ֽ⣬��Һ��Ȼ��̼��������Һ���ɴ��ж����Ǵ���ģ��ʴ�Ϊ���ң�
��2��A�����������غ㣬��c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)����ȷ��B�����ݵ���غ㣬��c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)������c��NaHCO3����ˮ���Լ��ԣ�˵��HCO3-�ĵ���̶�С��HCO3-��ˮ��̶ȣ�����ѡa��
��3��̼������Һ��̼��������Һ���Լ��ԣ���ѡ���̪��ָʾ��������������Һ�Եζ���������ʹ�õζ�����֣������Ҫ�����������µζ���������ѡ������ָʾ����̼������Һ�Լ��ԣ���ȡ20.00mL��Ȼ�մ�ˮӦ��ѡ�ü�ʽ�ζ��ܣ��ʴ�Ϊ�����ȣ���ʽ��
��4��0.05mol/LBa(OH)2��Һ��c(OH-)=0.1mol/L����Һ��pHΪ11��˵��c(H+)=1��10-11 mol/L�����Kw=1��10-12��0.1mol/LNa2CO3��Һ�д���CO32- + H2O![]() HCO3- + OH-��HCO3- + H2O
HCO3- + OH-��HCO3- + H2O ![]() H2CO3 + OH-���Ե�һ��ˮ��Ϊ����Kh1=
H2CO3 + OH-���Ե�һ��ˮ��Ϊ����Kh1=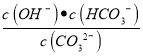 =
=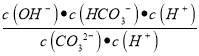 =
=![]() =
=![]() =0.025�� 0.025=
=0.025�� 0.025=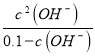 �����c(OH-)��0.04 mol/L��c(H+)=2.5��10-11 mol/L��pH=11- lg2.5���ʴ�Ϊ��11- lg2.5��
�����c(OH-)��0.04 mol/L��c(H+)=2.5��10-11 mol/L��pH=11- lg2.5���ʴ�Ϊ��11- lg2.5��
��5������ͭ��Һ�д��ڵ�Fe3+���ӵ�ˮ��ƽ�⣬��Һ�����ԣ�����Cu(OH)2����Һ�е�������Ũ�ȼ�С��ˮ��ƽ�������ƶ������������������������ӷ���ʽΪ2Fe3++3Cu(OH)2=2Fe(OH)3+3Cu2+����Ӧ��ƽ�ⳣ��K=![]() =
=![]() =
=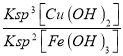 =
=![]() =5��1015���ʴ�Ϊ��2Fe3++3Cu(OH)2=2Fe(OH)3+3Cu2+��5��1015��
=5��1015���ʴ�Ϊ��2Fe3++3Cu(OH)2=2Fe(OH)3+3Cu2+��5��1015��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�