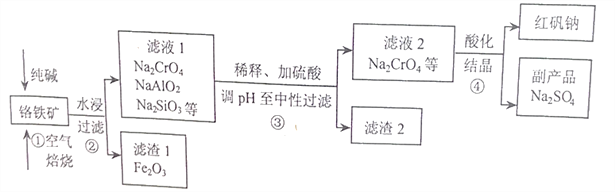
题目内容
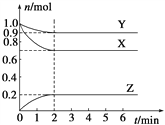
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为_______________。
(2)反应开始至2 min,气体Z的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时,压强是开始时的________倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热ΔH=_____________。
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。已知:
化学键 | H—H | H—Cl | Cl—Cl |
键能/ kJ·mol–1 | 436 | 431 | 242 |
工业上通过氢气在氯气中充分燃烧制取HCl气体,写出该反应的热化学反应方程式:_______________。
【答案】 3X+Y![]() 2Z 0.05 mol·L-1·min-1 0.90 -10a kJ·mol–1 H2(g) + Cl2(g) = 2HCl(g) ΔH=-184kJ·mol–1。
2Z 0.05 mol·L-1·min-1 0.90 -10a kJ·mol–1 H2(g) + Cl2(g) = 2HCl(g) ΔH=-184kJ·mol–1。
【解析】(1)根据图象知,随着反应进行,X、Y的物质的量减少而Z物质的量增大,说明X、Y是反应物而Z是生成物,达到平衡状态时,参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,同一反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,所以该反应方程式为 3X+Y![]() 2Z;(2)Z的平均反应速率=
2Z;(2)Z的平均反应速率=![]() =0.05mol/(L·min);(3)根据图象知,未反应时混合气体的物质的量=(1.0+1.0)mol=2.0mol,平衡状态混合气体物质的量=(0.9+0.7+0.2)mol=1.8mol,恒温恒容条件下,气体的物质的量之比等于其压强之比,所以平衡状态体系压强是开始时的1.8mol÷2.0mol=0.9倍;(4)化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,则氢气在氯气中燃烧的反应热=(436+242-2×431)kJ/mol=-184kJ/mol,所以该反应的热化学反应方程式为H2(g) + Cl2(g) =2HCl(g) ΔH=-184kJ·mol–1。
=0.05mol/(L·min);(3)根据图象知,未反应时混合气体的物质的量=(1.0+1.0)mol=2.0mol,平衡状态混合气体物质的量=(0.9+0.7+0.2)mol=1.8mol,恒温恒容条件下,气体的物质的量之比等于其压强之比,所以平衡状态体系压强是开始时的1.8mol÷2.0mol=0.9倍;(4)化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,则氢气在氯气中燃烧的反应热=(436+242-2×431)kJ/mol=-184kJ/mol,所以该反应的热化学反应方程式为H2(g) + Cl2(g) =2HCl(g) ΔH=-184kJ·mol–1。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案