题目内容
【题目】I.(1)根据如图所示情况,判断下列说法中正确的是 。
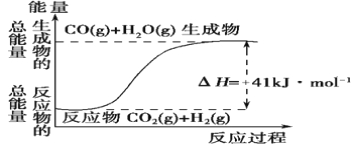
A.其热化学方程式为:CO(g)+ H2O(g)=CO2(g) + H2(g) ΔH=+41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g)=2NO(g) △H1
2H2(g)+ O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:已知反应2HI(g) ![]() H2(g)+I2(g) 的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g)+I2(g) 的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
【答案】
(1)B;
(2)H2(g)+0.5O2(g)=H2O(l) △H2=-285.8kJ·mol-1;
(3)2△H1+3△H2-2△H3;
(4)①MnO2+2I-+4H+=Mn2++I2+2H2O;②299。
【解析】
试题分析:(1)A、该反应热化学方程式为:CO2(g)+H2(g)=CO(g)+H2O(g)△H=41kJmol-1,故A错误;B、反应物能量小于生成物,正反应吸热,故B正确;C、正反应吸热,故C错误;D、水由气态变为液态放热,所以该反应吸热减少,其反应热的值小于41kJmol-1,故D错误;故答案为:B;
(2)1g氢气的物质的量为![]() =0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,则该反应的热化学方程式是2H2(g)+O2(g)=2H2O(1)△H=-571.6kJmol-1,故答案为:2H2(g)+O2(g)=2H2O(1) △H=-571.6kJmol-1;
=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,则该反应的热化学方程式是2H2(g)+O2(g)=2H2O(1)△H=-571.6kJmol-1,故答案为:2H2(g)+O2(g)=2H2O(1) △H=-571.6kJmol-1;
(3)由①N2(g)+O2(g)═2NO(g)△H1,
②2H2(g)+O2(g)═2H2O(g)△H2,
③N2(g)+3H2(g)═2NH3(g)△H3,
结合盖斯定律可知,①×2+②×3-③×2
可得4NH3(g)+5O2(g)═4NO(g)+6H2O(g),则△H4=2△H1+3△H2-2△H3;
(4)①海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,反应的离子方程式为:2I-+MnO2+4H+=Mn2++I2+2H2O,故答案为:2I-+MnO2+4H+=Mn2++I2+2H2O;
②设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,故答案为:299kJ。


