题目内容
【题目】关于下列各图的叙述正确的是( )
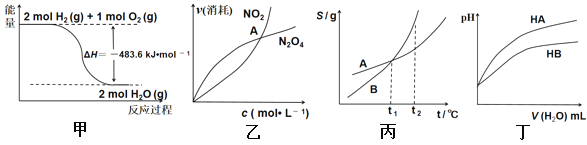
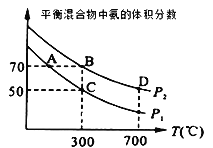
A. 甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
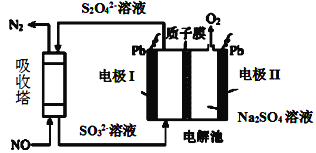
B. 乙表示恒温恒容条件下发生的可逆反应2NO2 (g)![]() N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
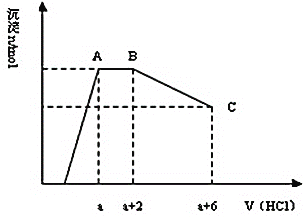
C. 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
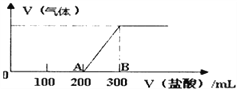
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
【答案】D
【解析】
A、燃烧热是1mol可燃物燃烧生成稳定的氧化物释放的热量,液态水是稳定的,且上图是2mol氢气燃烧放出的热量,故A错误;
B、反应2NO2N2O4(g)中,由图象可知,在A点反应物的消耗速率和生成物的消耗速率相等,其表明正反应速率和逆反应速率不等,没有达到化学平衡状态,故B错误;
C、t1℃时AB浓度相同,升温时,均无溶质析出,溶液的浓度不变,溶质的质量分数B等于A,故C错误;
D、随加水量的增多,HA的pH变化大,说明HA的酸性强于HB,根据越弱越水解的原则,NaB水解程度大,故NaA溶液的碱性弱于同浓度的NaB溶液的碱性,NaA溶液的pH小于同浓度的NaB溶液的pH,故D正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。