题目内容
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=____________。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)![]() CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
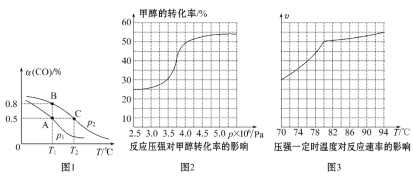
①合成甲醇的反应为______________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为____________________。p1和p2的大小关系为___________。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________(填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是___________________。
【答案】(1)ΔH1-3ΔH2-2ΔH3;(2)c、d;(3)①放热;②KA=KB>KC,p1<p2;③7;(4)①4.0×106Pa;②高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低。
【解析】
试题分析:(1)盖斯定律,推出:△H=ΔH1-3ΔH2-2ΔH3;(2)a、用不同反应速率表示达到化学平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,v(H2)正化学反应向正反应方向进行,v(CO)逆化学反应向逆反应方向进行,且速率之比等于4:2=2:1,能说明达到化学平衡,故错误;b、平衡常数只受温度的影响,此容器是绝热容器,温度发生改变,因此当化学平衡常数不变时,说明反应达到平衡,故错误;c、根据密度的定义,组分都是气体,气体质量不变,是恒容状态,体积不变,因此密度不变,不能说明反应达到平衡,故正确;d、两者体积比始终相等,不能作为达到平衡的标志,故正确;(3)①随着温度升高,CO的转化率降低,平衡向逆反应方向进行,根据勒夏特列原理,正反应方向是放热反应;②化学平衡常数只受温度的影响,KA和KB温度相等,因此KA=KB,温度升高平衡向逆反应方向进行,平衡常数减少,因此KA=KB>KC,作等温线,增大压强平衡向正反应方向进行,CO的转化率增大,即p2>p1;
③CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始:10 20 0
变化: 5 10 5
平衡: 5 10 5
等温等压下,体积比等于物质的量之比,开始时的容器的体积为30×10/20L=15L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始:10 20 0
变化: 8 16 8
平衡: 2 4 8
体积比等于物质的量之比,即14×15/30L=7L;(4)①根据图像,应选择压强为4.0×106Pa,5.0×106Pa,虽然甲醇的转化率大,但增加不多,如果选用5.0×106Pa,对设备的要求增加,成本提高,4.0×106Pa甲醇的转化率已经够大了,因此选择4.0×106Pa;②高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低。

 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案