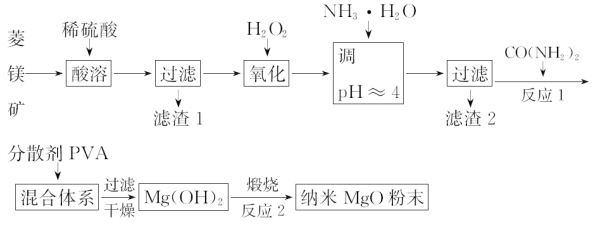
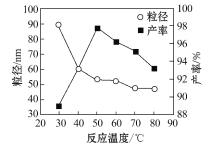
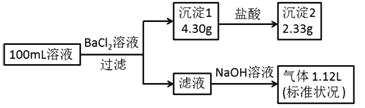
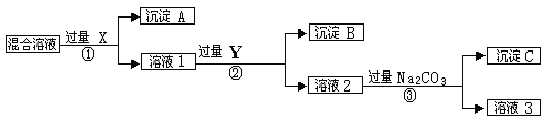
题目内容
【题目】下列说法正确的是
A. 常温常压下,1mol CH4的体积是22.4L
B. 1molFe在氯气中完全燃烧失去电子数为2NA
C. 用激光笔照射可鉴别Fe(OH)3胶体和FeCl3溶液
D. 用焰色反应可鉴别NaCl和Na2CO3
【答案】C
【解析】A、在标准状态下,1mol CH4的体积约为22.4L,故A错误;B、1molFe在氯气中完全燃烧生成FeCl3,所以失去电子数为3NA,即B错误;C、胶体具有丁达尔现象,而溶液没有此现象,故可用来鉴别Fe(OH)3胶体和FeCl3溶液,所以C正确;D、这两种物质中都含有Na元素,所以焰色反应不能鉴别,故D错误。本题正确答案为C。

练习册系列答案
相关题目