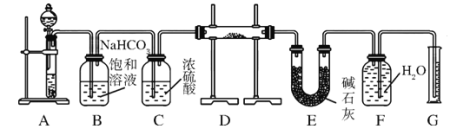
题目内容
【题目】海洋是一个巨大的宝藏,期待着人们的开发和利用,下列物质不经过化学变化就能从海水中获得的是
A. 单质溴 B. 单质镁 C. 烧碱 D. 食盐
【答案】D
【解析】试题分析:A.可从海水中获得氯化钠,通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子氧化为溴单质,是化学变化,故A错误;B.通过电解熔融的氯化镁得到镁,是化学变化,故B错误;C.把从海水中获得的氯化钠配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,是化学变化,故C错误;D.把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故D正确;故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目