题目内容
【题目】研究CO、CO2的应用具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ;
CH3OH(g)+H2O(g) ;
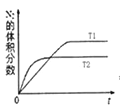
测得CH3OH的物质的量随时间的变化图:

①由图判断该反应ΔH 0,曲线I、II对应的平衡常数KI KII(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
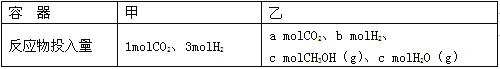
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(3)将燃煤废气中的CO转化为二甲醚的反应原理为:
2CO(g) + 4H2(g)![]() CH3OCH3(g) + H2O(g)。二甲醚与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负极反应式 。根据化学反应原理,分析增加压强对制备二甲醚反应的影响 。
CH3OCH3(g) + H2O(g)。二甲醚与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负极反应式 。根据化学反应原理,分析增加压强对制备二甲醚反应的影响 。
【答案】
(1)Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5 kJ·mol-1
(2)①< ;>; ②0.4<c≤1; ③ ab;
(3)CH3OCH3-12 e— +16OH— = 2CO32— +11H2O;该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大。
【解析】
试题分析:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
②C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJmol-1,
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0。根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ。
故答案为:<;>;
②在容积相同且固定的两个密闭容器中,要使平衡后乙与甲中相同组分的体积分数相等,则甲、乙两容器中最终形成完全相同的平衡状态,设甲达到平衡时生成CH3OH xmol,依据题意可知得关系式:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
n(起始/mol) 1 3 0 0
n(变化/mol) x 3x x x
n(平衡/mol) 1-x 3-3x x x
所以有![]() =0.8,解得x=0.4,
=0.8,解得x=0.4,
因此要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为:0.4<c≤1。
故答案为:0.4<c≤1;
③a.该反应是前后气体分子数不相等的反应,由于此反应在恒容的容器中进行,故容器中的压强不变,能作为平衡的依据,故a正确;
b.当反应未达平衡时,H2 的体积分数会一直减小,故当氢气的体积分数不变时,说明反应达平衡,故b正确;
c.当反应达平衡时,各物质的浓度之间无必然的数值关系,故当c(H2)=3c(CH3OH)时,反应不一定平衡,故c错误;
d.由于此反应是气体的质量不变,由于容器恒容,则气体的密度始终不变,故当容器中密度不变时,不能说明反应达平衡,故错误;
e.2个C=O 断裂的同时必定会有6 个H-H 断裂,不能说明反应达平衡,故e错误。
故选ab;
(3)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g)。当以二甲醚与空气设计成燃料电池,且电解质为碱性,则该燃料电池的负极反应式为:CH3OCH3-12 e— +16OH— = 2CO32— +11H2O;根据化学反应原理可知,该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大。
CH3OCH3(g)+ H2O(g)。当以二甲醚与空气设计成燃料电池,且电解质为碱性,则该燃料电池的负极反应式为:CH3OCH3-12 e— +16OH— = 2CO32— +11H2O;根据化学反应原理可知,该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大。
故答案为:2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g);该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加,且压强增加使CO和H2浓度增加,反应速率增大。
CH3OCH3(g)+ H2O(g);该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加,且压强增加使CO和H2浓度增加,反应速率增大。