题目内容
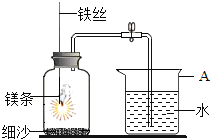
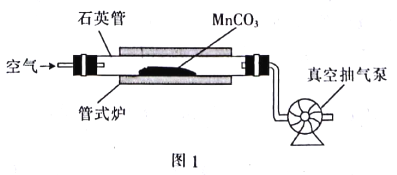
【题目】MnO2可作氧化剂、催化剂和干电池中的去极化剂,通过图1装置焙烧MrCO3可以制取MnO2。
已知:2MnO(s)+O2(g)=2MnO2(s) △H1=a kJ.mol-l
MnCO3 (s)=MnO(s)+CO2 (g) △H2=b kJ.mol-l
回答下列问题:
(1)写出图1装置中制取MnO2的热化学方程式:__________(△H用含a、b的代数式表示)。
(2)一定条件下,在1L恒容密闭容器中,该反应达到化学平衡时,CO2与O2的物质的量之比为m,氧气的物质的量为2 mol,则化学平衡常数K=__________。
(3)用真空抽气泵不断抽气的目的是___________(从化学平衡的角度回答)。
(4)某科研小组对碳酸锰与空气反应制备二氧化锰的条件(焙烧温度和气氛)进行了研究,获得三幅图(如图所示)。

①制备时焙烧温度为________,气氛条件为________。
②图2中是在常压(0.1 MPa)下获得的数据,试在图2中用虚线画出10 MPa下反应温度与转化率的关系图。__________________
【答案】 2MnCO3(s)+O2(g)=2MnO2(s)+2CO2 (g) △H=(a+2b) kJ/mol 2rn2 减小CO2的浓度,使平衡正向移动,提高MnCO3转化率 350℃左右(或325~375℃) 湿空气,其中水分含量为30%左右(或水分含量为20%~40%) 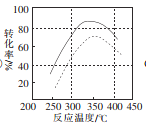
【解析】(1)由题中信息可知,可认为制取MnO2的过程先后发生了两个反应:①MnCO3 (s)=MnO(s)+CO2 (g) △H2=b kJ.mol-l,②2MnO(s)+O2(g)=2MnO2(s) △H1=a kJ.mol-l,由①![]() ②可得制取MnO2的热化学方程式为:2MnCO3(s)+O2(g)=2MnO2(s)+2CO2 (g) △H=(a+2b) kJ/mol 。
②可得制取MnO2的热化学方程式为:2MnCO3(s)+O2(g)=2MnO2(s)+2CO2 (g) △H=(a+2b) kJ/mol 。
(2)一定条件下,在1L恒容密闭容器中,该反应达到化学平衡时,CO2与O2的物质的量之比为m,氧气的物质的量为2 mol,则CO2的物质的量为2m mol,CO2与O2的物质的量浓度分别为2m mol/L和2mol/L,该反应的化学平衡常数K=![]() =2rn2。
=2rn2。
(3)用真空抽气泵不断抽气的目的是减小生成物CO2的浓度,使平衡正向移动,提高MnCO3转化率。
(4)由图可知,该反应在350℃左右(或325~375℃)、水分含量为30%左右(或水分含量为20%~40%)的湿空气中焙烧,化学反应速率最快且反应物的转化率最高。①制备时焙烧温度为350℃左右(或325~375℃),气氛条件为湿空气,其中水分含量为30%左右(或水分含量为20%~40%)。②该反应是一个气体分子数减少的反应,在相同温度下,增大加压后,化学平衡向逆反应方向移动,反应物的转化率会变小。图2中是在常压(0.1 MPa)下获得的数据,在图2中的曲线下方用虚线画出10 MPa下反应温度与转化率的关系图如下: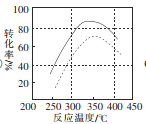 。
。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案