题目内容
在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
 2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为| A.2Q kJ | B.Q kJ | C.1.8Q kJ | D.0.9Q kJ |
C
试题分析:设反应放出的热量为x,
由2SO2(g)+O2(g)?2SO3(g)△H="-Q" KJ/mol
2 QkJ
4mol×90% x
2/ (4mol×90%)=QkJ/x
解得x=1.8QkJ, 故选C

练习册系列答案
相关题目
 CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表: cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
 CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。 W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。 Fe(SCN)3+3KCl的研究,下列说法不正确的是
Fe(SCN)3+3KCl的研究,下列说法不正确的是 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下: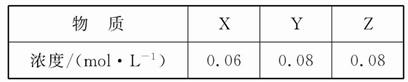
 2H2(g)+S2(g)
2H2(g)+S2(g)  H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是 nY(g) △H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) △H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示: