题目内容
某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
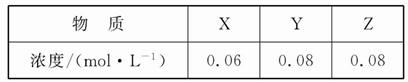
下列说法正确的是( )
 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
下列说法正确的是( )
| A.此时v(正)<v(逆) |
| B.平衡时Y的浓度为0.05 mol·L-1 |
| C.平衡时X的转化率为40% |
| D.增大压强使平衡向正反应方向移动,平衡常数增大 |
B
根据Qc=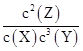 =0.082/(0.06×0.083)=208.3<1 600,反应没有达到平衡,向正反应方向移动,v(正)>v(逆),A错;若达到平衡时Y的浓度为0.05 mol·L-1,则Y在上面某时刻浓度的基础上又反应了0.03 mol·L-1,所以X、Y、Z的平衡浓度分别为0.05 mol·L-1、0.05 mol·L-1、0.1 mol·L-1,所以此时的Qc=0.12/(0.05×0.053)="1" 600,与此温度下的平衡常数数值相等,所以此时达到平衡状态, B对;根据表中数据可知起始时刻X、Y的浓度分别为0.1 mol·L-1、0.2 mol·L-1,达到平衡时X的浓度为0.05 mol·L-1,所以X的转化率为0.05 mol·L-1/0.1 mol·L-1×100%=50%,C错;增大压强,平衡正向移动,但是平衡常数不变,D错
=0.082/(0.06×0.083)=208.3<1 600,反应没有达到平衡,向正反应方向移动,v(正)>v(逆),A错;若达到平衡时Y的浓度为0.05 mol·L-1,则Y在上面某时刻浓度的基础上又反应了0.03 mol·L-1,所以X、Y、Z的平衡浓度分别为0.05 mol·L-1、0.05 mol·L-1、0.1 mol·L-1,所以此时的Qc=0.12/(0.05×0.053)="1" 600,与此温度下的平衡常数数值相等,所以此时达到平衡状态, B对;根据表中数据可知起始时刻X、Y的浓度分别为0.1 mol·L-1、0.2 mol·L-1,达到平衡时X的浓度为0.05 mol·L-1,所以X的转化率为0.05 mol·L-1/0.1 mol·L-1×100%=50%,C错;增大压强,平衡正向移动,但是平衡常数不变,D错
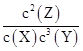 =0.082/(0.06×0.083)=208.3<1 600,反应没有达到平衡,向正反应方向移动,v(正)>v(逆),A错;若达到平衡时Y的浓度为0.05 mol·L-1,则Y在上面某时刻浓度的基础上又反应了0.03 mol·L-1,所以X、Y、Z的平衡浓度分别为0.05 mol·L-1、0.05 mol·L-1、0.1 mol·L-1,所以此时的Qc=0.12/(0.05×0.053)="1" 600,与此温度下的平衡常数数值相等,所以此时达到平衡状态, B对;根据表中数据可知起始时刻X、Y的浓度分别为0.1 mol·L-1、0.2 mol·L-1,达到平衡时X的浓度为0.05 mol·L-1,所以X的转化率为0.05 mol·L-1/0.1 mol·L-1×100%=50%,C错;增大压强,平衡正向移动,但是平衡常数不变,D错
=0.082/(0.06×0.083)=208.3<1 600,反应没有达到平衡,向正反应方向移动,v(正)>v(逆),A错;若达到平衡时Y的浓度为0.05 mol·L-1,则Y在上面某时刻浓度的基础上又反应了0.03 mol·L-1,所以X、Y、Z的平衡浓度分别为0.05 mol·L-1、0.05 mol·L-1、0.1 mol·L-1,所以此时的Qc=0.12/(0.05×0.053)="1" 600,与此温度下的平衡常数数值相等,所以此时达到平衡状态, B对;根据表中数据可知起始时刻X、Y的浓度分别为0.1 mol·L-1、0.2 mol·L-1,达到平衡时X的浓度为0.05 mol·L-1,所以X的转化率为0.05 mol·L-1/0.1 mol·L-1×100%=50%,C错;增大压强,平衡正向移动,但是平衡常数不变,D错
练习册系列答案
相关题目
 2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。 2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为 2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列: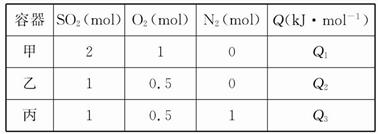
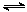 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
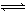 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是