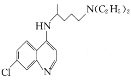
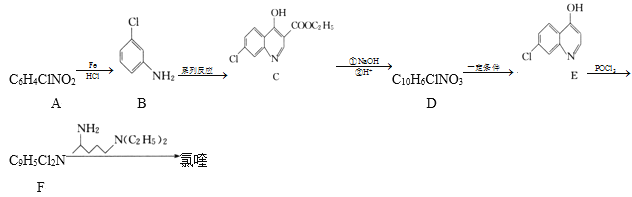
题目内容
【题目】某校化学学习小组分别设计了一组实验来探究元素周期律。
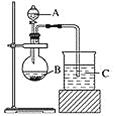
第一小组根据元素非金属性与其对应最高价含氧酸之间的关系,设计了如图装置来一次性完成同主族元素非金属性强弱比较的实验探究。
[查阅资料]
Ⅰ.常温下浓盐酸与高锰酸钾能反应生成氯气。
Ⅱ.H2SiO3难溶于水。
实验药品:大理石、碳酸钠粉末、稀硝酸、硅酸钠溶液。
[探究过程]
(1)第一小组为比较N、C、Si的非金属性强弱,以图中装置进行实验:
①烧杯C中现象为__________,发生反应的离子方程式为________________。
②实验预期结论:_______________________________________。
③存在问题:___________________________________________。
(2)第二小组设计了下图装置来验证卤素单质的氧化性,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
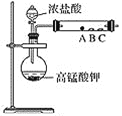
①写出A处反应的离子方程式:_______________________________。
②B处实验现象是____________________________________________。
③实验预期结论:____________________________________________。
④存在问题:________________________________________________。
【答案】溶液变浑浊 CO2+SiO32-+H2O=H2SiO3↓+CO32- 非金属性:C>Si 稀硝酸有一定的挥发性,影响C和Si非金属性强弱的判断 Cl2+2Br-=Br2+2Cl- 试纸变蓝 氧化性:Cl2>Br2>I2 无法判断Br2和I2的氧化性
【解析】
(1)验证元素的非金属性与其对应最高价含氧酸之间的关系,可根据强酸制弱酸的反应原理,用稀硝酸与大理石反应生成二氧化碳,再将二氧化碳通入硅酸钠溶液中,生成硅酸沉淀,由此可说明硝酸、碳酸及硅酸酸性的强弱,但硝酸有挥发性,影响了最后结果的判断;
(2)氯气与溴化钠溶液发生置换反应生成单质溴和氯化钠,说明氯气氧化性强于溴,氯气与碘化钾溶液发生置换反应生成单质碘,碘遇淀粉变蓝色,说明氯气氧化性强于碘,但无法判断Br2和I2的氧化性。
(1)①烧杯C中硅酸钠溶液与二氧化碳反应生成硅酸沉淀和碳酸钠,反应的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-;
②实验预期结论是同主族元素从上到下非金属性依次减弱,元素的非金属性C>Si,故答案为:非金属性:C>Si;
③硝酸有挥发性,挥发出的硝酸与硅酸钠溶液反应生成硅酸沉淀,会干扰C和Si非金属性强弱的判断,故答案为:稀硝酸有一定的挥发性,影响C和Si非金属性强弱的判断;
(2)①A处氯气与溴化钠溶液发生置换反应生成单质溴和氯化钠,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
②B处氯气与碘化钾溶液发生置换反应生成单质碘,碘遇淀粉变蓝色,故答案为:试纸变蓝;
③实验预期结论是同主族元素从上到下非金属性依次减弱,单质的氧化性依次减弱,单质的氧化性Cl2>Br2>I2,故答案为:氧化性:Cl2>Br2>I2;
④实验中没有设计溴与碘化钾淀粉溶液的反应,无法判断Br2和I2的氧化性,故答案为:无法判断Br2和I2的氧化性。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
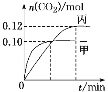
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
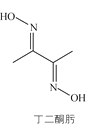
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
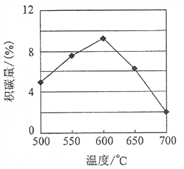
A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
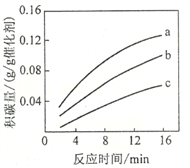
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。