题目内容
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室用丙醇、浓硫酸和溴化钠反应来制备少量1-溴丙烷。其反应原理、实验的装置和主要步骤如下:H2SO4(浓)+NaBr ![]() NaHSO4+HBr↑ CH3CH2CH2OH+HBr
NaHSO4+HBr↑ CH3CH2CH2OH+HBr ![]() CH3CH2CH2Br+H2O
CH3CH2CH2Br+H2O
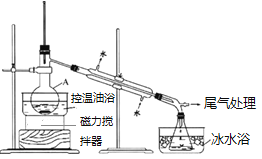
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓![]() ;冷却至室温,搅拌下加入24g NaBr。
;冷却至室温,搅拌下加入24g NaBr。
步骤2:如图所示连接实验装置,缓慢加热,直到没有油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用![]() 溶液
溶液 ![]() 洗涤,分液,得粗产品,进一步提纯得
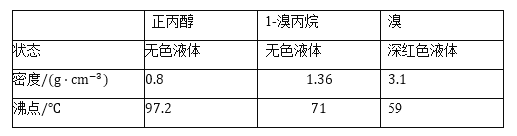
洗涤,分液,得粗产品,进一步提纯得![]() 溴丙烷。有关数据见下表:
溴丙烷。有关数据见下表:
(1)仪器A的名称的是_________;加入搅拌磁子的目的是搅拌和___________。
(2)反应时生成的主要有机副产物有丙烯、_________和___________。(填物质名称)
(3)反应过程中可以观察到A的上方出现红棕色气体,其分子式为__________。
(4)给A加热的目的是_______。
(5)步骡2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_______,同时可以观察到的现象是_____。
(6) 步骤4中三次洗涤分别洗去的主要杂质①__________②___________③___________ .
(7)步骤4中![]() 的
的![]() 溶液还可以用下列哪个试剂代替_____(填字母序号)
溶液还可以用下列哪个试剂代替_____(填字母序号)
A.NaOH溶液 ![]() 溶液 C.
溶液 C.![]() 溶液 D.
溶液 D.![]()
【答案】蒸馏烧瓶 防止暴沸 正丙醚 1,![]() 二溴丙烷 Br2 升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率 冷凝收集
二溴丙烷 Br2 升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率 冷凝收集![]() 溴丙烷;并起到液封
溴丙烷;并起到液封![]() 溴丙烷减少其挥发 溶液分层,下层为略带橙色的油状液体 正丙醇
溴丙烷减少其挥发 溶液分层,下层为略带橙色的油状液体 正丙醇 ![]()
![]()
![]() 。
。
【解析】
(1)由图可知,仪器A的名称是蒸馏烧瓶,加入搅拌磁子的目的是搅拌和防止暴沸,故答案为:蒸馏烧瓶;防止暴沸。
(2)正丙醇在浓硫酸作用下可能发生消去反应,或分子间取代反应,则反应时生成的主要有机副产物有1,2-二溴丙烷和丙烯、正丙醚,故答案为:1,2-二溴丙烷、正丙醚。
(3)根据题中所给信息可知A上方出现红棕色气体应为溴蒸气,化学式为Br2,故答案为:Br2。
(4)给A加热的目的是升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率,故答案为:升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率。
(5)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是冷凝收集![]() 溴丙烷;并起到液封
溴丙烷;并起到液封![]() 溴丙烷减少其挥发,同时可以观察到溶液分层,下层为略带橙色的油状液体,故答案为:冷凝收集
溴丙烷减少其挥发,同时可以观察到溶液分层,下层为略带橙色的油状液体,故答案为:冷凝收集![]() 溴丙烷,并起到液封
溴丙烷,并起到液封![]() 溴丙烷减少其挥发;溶液分层,下层为略带橙色的油状液体。
溴丙烷减少其挥发;溶液分层,下层为略带橙色的油状液体。
(6)步骤4:将分出的有机相转入分液漏斗,①用12mLH2O洗涤,主要是除去正丙醇,②用12mL5%Na2CO3溶液洗涤,主要是除去单质Br2,③再用12mLH2O洗涤,主要是除去Na2CO3,故答案为:正丙醇,Br2,Na2CO3。
(7)A.NaOH溶液:加NaOH会引起溴乙烷的水解,故A不选;
B.NaI溶液:除去溴乙烷中的少量杂质溴,加入NaI会引入碘单质杂质,故B不选;
C.Na2SO3溶液:加Na2SO3溶液只与溴反应不与溴乙烷反应,故C选;
D.CCl4:溴乙烷会溶解在CCl4中,故D不选。
故答案为:C。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
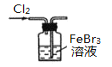
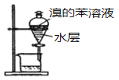
小学教材完全解读系列答案【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是
A | B | C | D |
|
|
|
|
制取Cl2 | 使Br-转化为Br2 | 分离出溴的苯溶液 | 将分液后的水层蒸干获得无水FeCl3 |
A.AB.BC.CD.D
【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。