题目内容
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,固体全部溶解,且还原产物只有NO2和NO。将反应后溶液用蒸馏水稀释至100 mL,测得c(NO3-)=4 mol·L-1。
(1)稀释后的溶液中c(H+)= mol·L-1
(2)若a=10,则生成的气体中NO2的物质的量为________mol
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若上述混合气体被1 mol·L-1的NaOH溶液恰好吸收,则NaOH溶液的体积为________mL
(1)2 (2)0.05 (3)100
解析试题分析:(1)在稀释后的溶液中含有Cu(NO3)2、HNO3。根据物料守恒可得n(NO3-)=2n(Cu2+)+n(H+).n(Cu2+)=6.4g÷64g/mol=0.1mol; n(NO3-)="4" mol/L×0.1L=0.4mol。所以n(H+)= 0.4mol-2×0.1mol=0.2mol.稀释后的溶液中c(H+)=n(H+)÷V=0.2mol÷0.1L=2mol/L。(2)若a=10,n(HNO3)(总)=0.05L×10mol/L=0.5molL; 根据n(HNO3)( 剩余)=0.2mol.则反应消耗的硝酸的物质的量为0.3mol.开始的硝酸为浓硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。,随着反应的进行 硝酸变为稀硝酸,发生反应: 3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O假设产生的NO2、NO的物质的量分别为x、y.则根据方程式中Cu与硝酸的物质的量关系可得x/2+3y/2=0.1;2x+4y=0.3.解得x=0.05;y=0.05.因此生成的气体中NO2的物质的量为0.05mol。(3)由方程式可以看出n(NOx)=n(NaOH).n(NOx)=n(NO2)+n(NO)= 0.05+0.05=0.1mol。所以n(NaOH)=0.1mol.V(NaOH)=n÷C=0.1mol÷1mol/L=0.1L=100ml。
考点:考查守恒法在金属与硝酸反应的计算中的应用的知识。

向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L |
| B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) |
| D.原溶液中c(Br-)=0.4mol/L |
 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
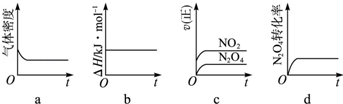
 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。