题目内容
【题目】油脂是重要的营养物质。某天然油脂A可发生下列反应:
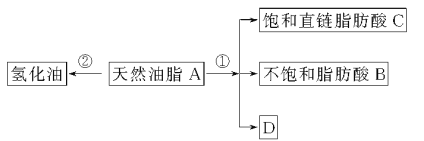
已知:A的分子式为C57H106O6。1 mol该天然油脂A经反应①可得到1 mol D、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:______________。
(2)写出反应①的反应类型:______________;C的名称(或俗称)是______________。
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程。下列有关说法不正确的是______________。
a.氢化油又称人造奶油,通常又叫硬化油
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂
d.油脂的氢化与油脂的皂化都属于加成反应。
(4)D和足量金属钠反应的化学方程式:_______________。
【答案】(1)C18H32O2
(2)取代(或水解) 硬脂酸(或十八酸)(3)d
(4)2C3H5(OH)3+6Na―→2C3H5(ONa)3+3H2↑
【解析】(1)利用题给B分子中C、H、O原子个数比可得出B的最简式,然后利用B的相对分子质量可求出B的分子式为C18H32O2。(2)由转化关系可知反应①为油脂的水解反应(或取代反应),油脂为高级脂肪酸与甘油形成的酯,故可知D为甘油(C3H8O3),利用原子守恒,结合B的分子式与A的分子式可知,C的分子式为C17H35COOH,名称为硬脂酸。(3)油脂的皂化反应属于取代反应,故结合题给选项和有关信息可知d项说法不正确。(4)类比乙醇与Na的反应(金属钠可以置换出羟基中的H生成氢气),可知甘油D与足量金属钠反应的方程式。

【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①该反应的熵变△S0 ( 填:“<,>,=”).该反应在(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率AC(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数AC,由状态B到状态A,可采用的方法(填“升温”或“降温”). 
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5molL﹣1 盐酸、0.55molL﹣1NaOH溶液,尚缺少的实验玻璃用品是、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”).
(3)他们记录的实验数据如下:已知:Q=Cm(t2﹣t1),反应后溶液的比热容C为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . ①计算完成下表.(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 中和热△H | ||
t1 | t2 | ||||
① | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将(填“变大”或“变小”或“无影响”).