��Ŀ����
����Ŀ���穁Fenton��������ˮ�����л���Ⱦ�オ��ĸ������������䷴Ӧԭ����ͼ��ʾ�����е�������H2O2��Fe2+����Fenton��Ӧ��Fe2++H2O2=Fe3++OH��+OH�����ɵ��������ɻ���OH�������������л���Ⱦ�����˵������ȷ���ǣ� �� 
A.��Դ��A���Ǹ���
B.������ֻ��O2��Fe3+������ԭ��Ӧ
C.�����Ϸ����缫��Ӧ��H2O��e��=OH+H+ ��
D.����1molO2 �� ���Բ���4molOH
���𰸡�B
���������⣺A����Դ��A�缫���ӵĵ缫�Ϸ����õ��ӵĻ�ԭ��Ӧ����õ缫Ϊ����������AΪ��������A��ȷ�� B��O2��Fe3+�������ϵõ��ӷ�����ԭ��Ӧ��H2O2���������ӷ�Ӧ����H2O2�����õ��ӵĻ�ԭ��Ӧ����B����
C��������ˮʧ���������ǻ��������ӣ���缫����ʽΪ��H2O��e��=OH+H+ �� ��C��ȷ��
D��1molO2ת��Ϊ2molH2O2ת��2mole�� �� ��Fe2++H2O2=Fe3++OH��+OH��֪������2molOH��ת��2mole�� �� ������������2molOH����������1molO2 �� ���Բ���4molOH����D��ȷ��
��ѡB��

����Ŀ��800��ʱ����2L���ܱ������з�����Ӧ��2NO��g��+O2��g��2NO2 �� n��NO����ʱ��ı仯�����ʾ��
ʱ��Ms | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO���Mmol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����0��3s�ڣ���NO��ʾ��ƽ����Ӧ����v��NO��= ��
��2��ͼ�б�ʾNOŨ�ȱ仯��������������ĸ���ţ��� 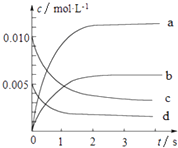
��3����ƽ��ʱNO��ת����Ϊ ��
��4����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ��� A������������ɫ���ֲ���
B�����������ܶȱ��ֲ���
C��v�� ��NO2��=2v�� ��O2��
D����������ƽ����Է����������ֲ���
��5�������µ�850�棬��ƽ���n��NO��=n��NO2������Ӧ���������Ӧ�����淴Ӧ�����ƶ���
��6������һ��������0.2molNO������������Ӧ����ƽ��ʱ��÷ų�������ΪakJ����ʱNOת����Ϊ80%����2molNO������ȫ��Ӧ�ų�������Ϊ ��