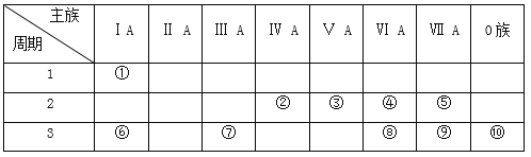
题目内容
【题目】甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为( )
A.5.4 gB.3.6 gC.2.7 gD.1.8 g
【答案】A
【解析】
根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,反应结束后测得生成的气体体积比为甲:乙=1:2,由化学反应方程式可知,酸与金属反应时酸不过量,碱与金属反应时碱过量来计算解答。
根据方程式,当铝分别和盐酸、氢氧化钠反应时,若消耗等量的铝,生成的气体体积比为1:1。若铝过量,等量的盐酸和氢氧化钠,生成的气体体积比为2:1。所以当两烧杯中生成的气体体积比为1:2时,可推知两烧杯中,生成的气体少的甲烧杯中铝有剩余,生成气体多的乙烧杯中铝不足。因为等量的铝消耗的盐酸物质的量更大,故甲烧杯中装盐酸;乙烧杯中装氢氧化钠。盐酸和氢氧化钠溶液中溶质的物质的量均为![]() ,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则
,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则
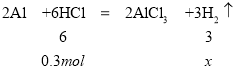
解得x=0.15mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为![]() ,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则
,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则
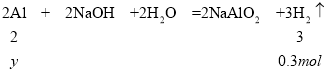
解得y=0.2mol,则铝的质量为![]() 。
。
故答案选:A。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】已知A(g) +B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/0C | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.1 | 1.0 | 0.5 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H_____0(填“<” “>”或 “=”);
(2)830℃时,向体积为10L的密闭容器中充入0.2mol的A和0.2mol的B,如反应初始到10s内A的平均反应速率v(A)=0.001 mol·L-1·s-1,则10s时c(D)=_____。此时,该反应是否处于平衡状态:___(填“是”或“否”)。达到平衡时A的转化率为__________,如果这时向该密闭容器中充入1mol氦气,A的转化率__________(填“变大”、“变小”或“不变”)。
(3)可用于判断该反应达到平衡状态的依据为________(填选项符号):
a、压强不随时间改变 b、气体的密度不再发生改变
c、c(D)不随时间改变 d、单位时间内生成A和C的物质的量相等
(4)1000℃时反应C(g)+D(g) ![]() A(g) +B(g)的平衡常数的值为___________。
A(g) +B(g)的平衡常数的值为___________。