题目内容
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
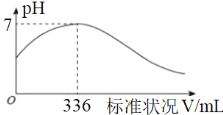
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
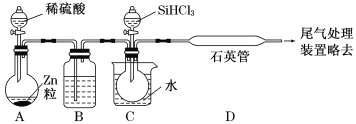
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
【答案】还原剂 1.204×1023或0.2NA 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 SiHCl3+H2![]() Si+3HCl bd
Si+3HCl bd
【解析】
(1)根据工艺流程写出化学方程式,从化合价的变化判断焦炭的作用,根据化学方程式和质量关系求出转移的电子数;
(2) ①A生成的氢气经过干燥,进入D与从C中汽化的SiHCl3反应制粗硅,B是干燥装置,②氢气和SiHCl3发生置换反应,写出化学方程式;
③选择检验亚铁离子的试剂;
(1)根据流程可知,化学方程式为SiO2+2C![]() Si+2CO,碳的化合价升高,做还原剂, 1mol SiO2参加反应转移的电子数为4mol,反应中消耗了3.0 g SiO2 ,n=
Si+2CO,碳的化合价升高,做还原剂, 1mol SiO2参加反应转移的电子数为4mol,反应中消耗了3.0 g SiO2 ,n=![]() =0.05 mol,转移电子为0.2 mol,即1.204×1023或0.2NA;
=0.05 mol,转移电子为0.2 mol,即1.204×1023或0.2NA;
(2)SiHCl3能与H2O强烈反应,需要用浓硫酸干燥氢气,反应需要的温度比较高,在D中反应,SiHCl3的沸点较低,C中的烧瓶需要加热是为了使滴入烧瓶中的SiHCl3汽化;
②装置D中有硅单质生成,即有固体物质生成 。此反应为 SiHCl3+H2![]() Si+3HCl;
Si+3HCl;
③亚铁离子的检验通常用的方法是:先向溶液中加入KSCN,溶液不变红色,再加入氯水溶液变红色,即可却确定有亚铁离子,答案为bd。

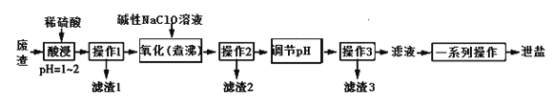
【题目】泄盐(MgSO4·7H2O)是一种中药药剂,还可用于制革、肥料、瓷器、印染料等工业。一种利用氯碱工业的废渣(主要成分是Mg(OH)2,杂质为MnCO3、FeCO3、Al(OH)3、SiO2等)生产泄盐的流程如下:
已知部分氢氧化物沉淀pH如下表:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Al(OH)3在pH=7.8时开始溶解,pH=10.0完全溶解 |
开始沉淀的pH | 2.3 | 10.8 | 3.7 | |
完全沉淀的pH | 4.3 | 12.4 | 5.2 |
回答下列问题:
(1) “酸浸”是工业对矿物利用的一种方法,该操作关键是提供浸取率和浸取速率,写出提高该工艺流程中“酸浸”速率的2种方法:___________________。
(2) “操作1” “操作2”和“操作3”相同,实验室在进行该操作时,用到的玻璃仪器有________,“滤渣1”的成分是________(写化学式)。
(3) “氧化(煮沸)”操作的目的是使溶液中的锰元素转化为MnO2,写出该反应的离子方程式:____________________。
(4)“调节pH”时最好选用__________, pH范围应控制为____________,高温加热“滤渣3”可得到_________(写化学式)。
(5) “一系列操作”是指_____________________________。
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应