题目内容
2.物质的量浓度相同的下列溶液:①H2CO3;②Na2CO3;③NaHCO3;④NH4HCO3;⑤(NH4)2CO3;其中c(CO32-)由大到小的排列顺序正确的是( )| A. | ②>⑤>③>④>① | B. | ⑤>②>④>①>③ | C. | ②>⑤>④>③>① | D. | ②>③>⑤>①>④ |
分析 H2CO3是弱酸部分电离;
Na2CO3是强碱弱酸盐,水解时碳酸根离子与水电离出的氢离子结合;
NaHCO3是强碱弱酸盐的酸式盐,水解时碳酸氢根离子与水电离出的氢离子结合;
NH4HCO3溶液中是弱酸弱碱的酸式盐,发生相互促进的水解;
(NH4)2CO3是弱酸弱碱盐,发生相互促进的水解,以此解答该题.
解答 解:②⑤相比较,⑤发生互促水解,c(CO32-)的大小为②>⑤,③④以水解为主,且④发生互促水解,c(CO32-)较小,①为二元弱酸,c(CO32-)最小,则c(CO32-)的大小关系为Na2CO3>(NH4)2CO3>NaHCO3>NH4HCO3>H2CO3,
故选A.
点评 本题考查了离子浓度大小比较、电离平衡移动等知识点,根据溶液中的溶质及其性质确定溶液中离子浓度大小,再结合外界条件对化学平衡的影响来确定溶液中离子浓度变化,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
12.在t℃时,10L 0.4mol•L-1H2O2溶液发生催化分解:2H2O2═2H2O+O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
下列叙述正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
| A. | 0~2min H2O2平均反应速率比4~6min慢 | |
| B. | 反应至6min时,共产生O244.8L | |
| C. | 0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol•L-1•min-1 | |
| D. | 反应至6min时,c(H2O2)=0.3mol•L-1 |
13.下列有关化学反应及其分类的叙述不正确的是( )
| A. | 金属的冶炼、电镀、燃料的燃烧、食物的腐败、钢铁的锈蚀等均属于氧化还原反应 | |
| B. | 将铁片投入硫酸铜溶液中所发生的置换反应既属于氧化还原反应,又属于离子反应 | |
| C. | 有单质参与的化学反应一定是氧化还原反应 | |
| D. | 氧化还原反应一定发生电子转移 |
17.常言“真金不怕火炼”从化学的角度对这句话的理解正确的是( )
| A. | 金的熔点高,难于融化 | |
| B. | 金的化学性质稳定,不易与其他物质反应 | |
| C. | 金越练越纯 | |
| D. | 金的硬度大,高温下难于变形 |
7.下列物质中,既能发生消去反应,又能催化氧化生成醛的是( )
| A. | CH3OH | B. | C2H5OH | C. | (CH3)3COH | D. | (CH3)3CCH2OH |
14.下列理解中正确的是( )
| A. | 有机物一定含有C元素 | |
| B. | 能够写出电离方程式的物质在书写离子方程式中一定可以拆 | |
| C. | 有机物中不可能含有金属元素 | |
| D. | AlCl3 属于离子化合物 |
17.如表实验装置示意图、实验现象及解释均正确的是( )
| A | B | C | D | |
实验 | 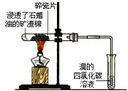 | 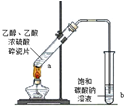 | 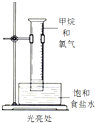 |  |
| 现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 | 量筒内壁产生油状液滴 | 反应过程中钠未熔化成小球 |
解释 | 石蜡油分解产物中 仅含有烯烃 | 反应生成难溶于饱和碳酸钠 溶液的乙酸乙酯 | 甲烷和氯气反应,生成了CH2Cl2、CHCl3、CCl4 | 反应吸热 |
| A. | A | B. | B | C. | C | D. | D |
 短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: ,元素D位于元素周期表的第ⅥA族.
,元素D位于元素周期表的第ⅥA族. +2
+2 →
→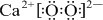 .
.