题目内容
10.1mol氧气的质量是1个氧气分子质量多少倍.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
解答 解:由n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$可知,1mol氧气的质量等于NA个氧气分子的质量,所以1mol氧气的质量是1个氧气分子质量NA倍.
答:1mol氧气的质量是1个氧气分子质量NA倍.
点评 本题考查物质的量的计算,为高频考点,侧重于基本概念的理解和运用的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
20.下列实验现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入新制氯水,再向溶液中加入KSCN溶液 | 溶液变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A. | A | B. | B | C. | C | D. | D |
1.将反应Mn2++Bi3-+H+→MnO4-+Bi3++H2O配平后,H+的化学计量数为( )
| A. | 8 | B. | 10 | C. | 14 | D. | 30 |
18.下列各组离子在饱和氯水中能大量共存的是( )
| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、Br- | D. | Na+、K+、HCO3-、SiO32- |
5.某元素的原子最外层只有一个电子,它与ⅦA元素结合时形成的化学键的说法正确的是( )
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 以上说法都不正确 |
15.下列制备实验不可能成功的是( )
| A. | 将冰醋酸、乙醇和浓硫酸混合共热制取乙酸乙酯 | |
| B. | 将乙醇和3mol/L的硫酸按体积比1:3混合共热至170℃制乙烯 | |
| C. | 蔗糖在酸性条件下水解后与新制的氢氧化铜共热能看到红色沉淀 | |
| D. | 用苯、液溴和还原铁粉制溴苯 |
2.物质的量浓度相同的下列溶液:①H2CO3;②Na2CO3;③NaHCO3;④NH4HCO3;⑤(NH4)2CO3;其中c(CO32-)由大到小的排列顺序正确的是( )
| A. | ②>⑤>③>④>① | B. | ⑤>②>④>①>③ | C. | ②>⑤>④>③>① | D. | ②>③>⑤>①>④ |
4.下列各表述与示意图一致的是(
| A. | 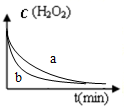 图表示双氧水分解时反应物浓度随时间的变化情况,a为加入少量FeCl3时的变化情况 | |
| B. | 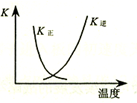 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 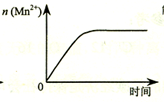 图表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 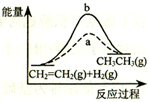 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H>0反应过程中的能量变化,a为不加催化剂时的过程 |
5.A、B、D、E四种元素均为短周期元素,原子序数逐渐增大,A元素原子的核外电子数、电子层数和最外层电子数均相等,B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的10电子分子,溶于水显碱性;甲、乙为非金属单质;X分子含有10个电子,常温下为无色液体.它们之间的转化关系如图②所示.已知W和甲反应生成乙和X是置换反应,
请回答下列问题:

(1)W的电子式为
(2)甲和乙反应生成标准状况下1.12LY,吸收9.025kJ的热量,写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+361kJ/mol
(3)用石墨做电极电解NaE溶液的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.平衡转化率指某一可逆化学反应达到平衡状态时,转化为目的产物的某种原料量占该种原料起始量的百分数,则该条件下A2的平衡转化率为33.3%.
请回答下列问题:
| B | D | |
| E |

(1)W的电子式为

(2)甲和乙反应生成标准状况下1.12LY,吸收9.025kJ的热量,写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+361kJ/mol
(3)用石墨做电极电解NaE溶液的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.平衡转化率指某一可逆化学反应达到平衡状态时,转化为目的产物的某种原料量占该种原料起始量的百分数,则该条件下A2的平衡转化率为33.3%.