题目内容
【题目】S2Cl2和SCl2均为重要的化工原料。
已知:I.S2(l) + Cl2(g)![]() S2Cl2(g) ΔH1;
S2Cl2(g) ΔH1;
II. S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g) ΔH2;
2SCl2 (g) ΔH2;
III.相关化学键的键能如下表所示:
化学键 | S—S | S—Cl | Cl—Cl |
键能/kJ mol-1 | a | b | c |
请回答下列问题:
(1) SCl2的结构式为______________________。
(2)若反应II正反应的活化能E=dkJ·mol-1,则逆反应的活化能E2=_______kJ·mol-1(用含a、b、c、d的代数式表示)。
(3)—定压强下,向10 L密闭容器中充入1molS2Cl2和1mol Cl2,发生反应II。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示:
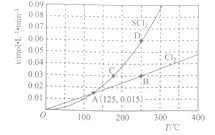
①A、B、C、D四点对应状态下,达到平衡状态的有 ____________(填字母),理由为__________。
②ΔH2_______________0(填“>” “<” 或“=”)。
(4)已知:ΔH1<0。向恒容绝热的容器中加入一定量的S2(l)和Cl2(g),发生反应I,5 min时达到平衡。则3 min时容器内气体压强__________(填“>” “<” 或“=”)5 min时的压强。
(5)—定温度下,在恒容密闭容器中发生反应I和反应II,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________(填“增大”“减小”或“不变”),理由为_________________。
【答案】 C1—S—Cl (2b+d-a-c) BD B、D两点对应的状态下,用同一物质表示的正、逆反应速率相等 < < 不变 反应I和反应Ⅱ均为左右两边气体分子总数相等的反应,压强对平衡没有影响
【解析】(1)根据SCl2的组成可知,S元素是+2价,Cl元素为-1价,所以其结构式为C1-S-Cl。(2)反应热等于正反应活化能与逆反应活化能的差值,也等于反应物的键能之和与生成物键能之和的差值,所以若反应II正反应的活化能E=dkJ·mol-1,则逆反应的活化能E2=(2b+d-a-c)kJ·mol-1。(3)①根据反应II:S2Cl2 (g) +Cl2 (g)![]() 2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;②B、D点为平衡点,由图中数据可知,B、D点的状态对应的温度为250℃,300℃时,SCl2的消耗速率大于氯气的消耗速率的2倍,说明平衡逆向移动,则正反应为放热反应,ΔH2<0。(4)该反应是左右两边气体分子数相等的反应,反应过程中气体总的物质的量不变,所以温度越高,气体膨胀程度越大,容器内气体压强越大;(5)反应I和反应II均为反应前后体积不变的反应,压强对平衡没有影响。
2SCl2 (g)可知,用氯气的消耗速率表示正反应速率和用SCl2的消耗速率表示逆反应速率,二者之比为1:2时转化为用同一种物质表示的正逆反应速率相等,达到平衡状态,由图像可知B、D点时的正逆反应速率之比为1:2,达到平衡状态;②B、D点为平衡点,由图中数据可知,B、D点的状态对应的温度为250℃,300℃时,SCl2的消耗速率大于氯气的消耗速率的2倍,说明平衡逆向移动,则正反应为放热反应,ΔH2<0。(4)该反应是左右两边气体分子数相等的反应,反应过程中气体总的物质的量不变,所以温度越高,气体膨胀程度越大,容器内气体压强越大;(5)反应I和反应II均为反应前后体积不变的反应,压强对平衡没有影响。

