题目内容
【题目】某校课外活动小组的同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.
(1)【实验探究】
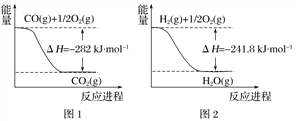
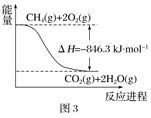
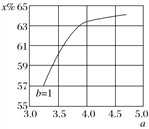
木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,其中浓H2S04所起的作用是(填“氧化剂”或“还原剂”).若有0.2mol的H2S04完全参加反应,则消耗碳的质量是g,(碳的摩尔质量为12gmol﹣1)同时产生的CO2的体积是(标况下)L
(2)A装置中品红溶液颜色(填“褪色”或“不褪色”),证明含有气体.
(3)B装置的作用是列用足量的酸性高锰酸钾溶液除尽SO2气体.
C装置中的澄清石灰水是用来检验CO2气体,现象是产生沉淀(填“白色”或“黄色”).
(4)【实验讨论】
有同学对B装置能否除尽SO2气体有有疑义,你认为应该在B、C装置之间连接右图中装置,以确定SO2是否除尽.
(5)【联系实际】
煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是 , 二氧化碳造成的环境影响主要是 . (每空格只填一个选顼)
A.酸雨 B.破坏臭氧层 C.温室效应
(6)目前,发展低碳经济、倡导低碳生活成为国民的共识.请你举一个体现低碳理念的事例 .
【答案】
(1)氧化剂,1.2,2.24
(2)褪色,SO2(或二氧化硫)
(3)白色
(4)a
(5)A,C
(6)采周乘坐公共交通工具、骑自行车或步行等方式出行,少用私家车(或节约用水、用电;改善能源结构,开发新能源(开发无污染的太阳能、风能、地热能)
【解析】解:(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,反应中硫酸分子中S元素的化合价降低,被含有,所以浓H2S04所起的作用为氧化剂;若有0.2mol的H2S04完全参加反应,则消耗碳的物质的量为0.1mol,质量为:12g/mol×0.1mol=1.2g,同时产生的CO2的物质的量为0.11mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L,
所以答案是:氧化剂; 1.2;2.24L;
(2)反应中有二氧化硫生成,则图一的A装置中品红溶液颜色褪色,证明了混合气体中含有SO2,
所以答案是:褪色; SO2(或二氧化硫);
(3)澄清石灰水中通入二氧化碳,二者反应生成白色的碳酸钙沉淀,
所以答案是:白色;
(4)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接图2中的a﹣品红溶液,用于检验二氧化硫气体是否除尽,
所以答案是:a;
(5)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是酸雨,所以A正确;
二氧化碳造成的环境影响主要是温室效应,所以C正确,
所以答案是:A;C;
(6)体现低碳理念的事例有:①采周乘坐公共交通工具、骑自行车或步行等方式出行,②少用私家车或节约用水、用电,③改善能源结构,开发新能源(开发无污染的太阳能、风能、地热能),
所以答案是:采周乘坐公共交通工具、骑自行车或步行等方式出行,少用私家车(或节约用水、用电;改善能源结构,开发新能源,如:开发无污染的太阳能、风能、地热能).

【题目】下列图中的实验方案,能达到实验目的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 探究温度对平衡的影响 | 比较HCl、H2CO2和 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
A.A
B.B
C.C
D.D