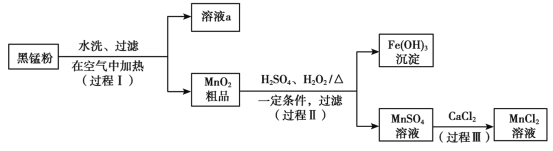
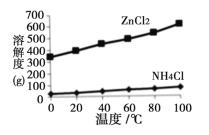
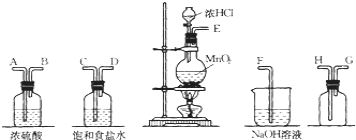
题目内容
【题目】Ⅰ![]() 从海水得到的粗食盐水中常含
从海水得到的粗食盐水中常含![]() 、
、![]() 、
、![]() ,需要分离提纯
,需要分离提纯![]() 现有含少量
现有含少量![]() 、
、![]() 的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂
的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂![]() 盐酸、
盐酸、![]() 、
、![]() 、
、![]() 来除去食盐水中
来除去食盐水中![]() 、
、![]() 、
、![]() 提纯时的操作步骤和加入试剂的情况如图1。
提纯时的操作步骤和加入试剂的情况如图1。
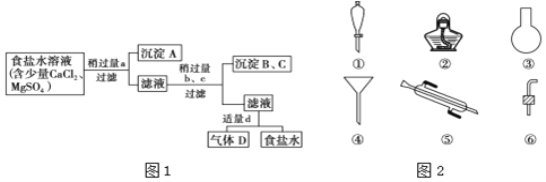
图1中a、b、c、d分别表示上述4种试剂中的一种,试回答:
![]() 沉淀A的名称是______.
沉淀A的名称是______.
![]() 试剂d是______;判断试剂d适量的方法是______.
试剂d是______;判断试剂d适量的方法是______.
![]() 加入b、c后溶液中发生的化学反应的化学方程式为______.
加入b、c后溶液中发生的化学反应的化学方程式为______.
Ⅱ![]() 海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的______
海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的______![]() 填序号
填序号![]() ,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做______.
,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做______.
【答案】硫酸钡 盐酸 溶液不再产生气体 MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl ① 萃取
【解析】
(1)现有含少量![]() 、
、![]() 的粗食盐水进行提纯,需要除去钙离子和镁离子和硫酸根离子,钙离子转化为碳酸钙沉淀,镁离子转化为氢氧化镁沉淀,硫酸根离子转化为硫酸钡沉淀,为了能完全除去,所以加入试剂均过量,注意后面要能将剩余的杂质离子除去,所以先加入氯化钡溶液,再加入碳酸钠或氢氧化钠,待沉淀完全后过滤,再加入盐酸除去剩余的氢氧根离子和碳酸根离子。
的粗食盐水进行提纯,需要除去钙离子和镁离子和硫酸根离子,钙离子转化为碳酸钙沉淀,镁离子转化为氢氧化镁沉淀,硫酸根离子转化为硫酸钡沉淀,为了能完全除去,所以加入试剂均过量,注意后面要能将剩余的杂质离子除去,所以先加入氯化钡溶液,再加入碳酸钠或氢氧化钠,待沉淀完全后过滤,再加入盐酸除去剩余的氢氧根离子和碳酸根离子。
(2)根据碘在四氯化碳等有机溶剂中的溶解度比在水中大分析,采用萃取分液的方法提纯。
Ⅰ![]() (1)先加入氯化钡溶液,沉淀A为硫酸钡;
(1)先加入氯化钡溶液,沉淀A为硫酸钡;
(2)试剂d为盐酸,盐酸和碳酸钠反应生成二氧化碳,判断其适量的方法为采用滴加的方式,看是否有气泡产生,若无气泡,说明盐酸适量;
(3)加入氢氧化钠溶液,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,加入碳酸钠溶液,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠。方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl;
Ⅱ![]() 从碘水中提取碘,用萃取分液的方法,使用分液漏斗,选择①;碘水加入四氯化碳的操作方法为萃取。
从碘水中提取碘,用萃取分液的方法,使用分液漏斗,选择①;碘水加入四氯化碳的操作方法为萃取。

 阅读快车系列答案
阅读快车系列答案【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
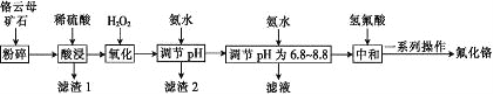
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。
【题目】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数![]() (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
压强/MPa | 10 | 20 | 30 | 40 |
| 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
A.10 MPa时,H2的转化率为75%
B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍
C.40 MPa时,若容器的体积为V L,则平衡常数K=![]()
D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动