题目内容
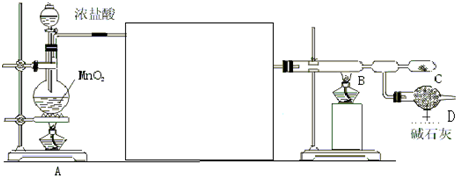
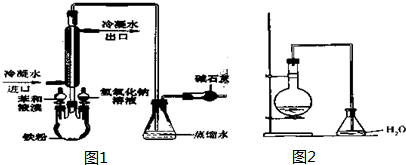
19.实验室用下面(图2)装置制取少量溴苯,试填写下列空白.(1)在烧瓶a中反应的化学方程式是
 .
.(2)长直导管b的作用:一是导气,二是冷凝回流.
(3)分析导管c的下口能不能浸没于液面中?为什么?不能,因为生成的溴化氢极易溶于水,造成锥形瓶内的液体倒吸入烧瓶
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有淡黄色沉淀生成,此现象说明这种获得溴苯的反应属于取代反应(填有机反应类型).
(5)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体生成,这可能是因为多余的液溴溶于溴苯的缘故.获得纯净的溴苯所用的主要试剂是NaOH溶液.纯溴苯为无色液体,它的密度比水重(轻或重).将溴苯和苯的混合物分离的操作是蒸馏
(6)采用(图1)装置进行实验,比较两个实验,请指出(图1)的两个优点有尾气处理、充分冷凝回流.
分析 本题是对教材苯和液溴反应得溴苯的实验的探究,涉及反应原理是苯和液溴发生取代反应,由于苯和液溴易挥发,为提高原料利用率采用长导管发挥冷凝回流的作用,因生成的溴化氢极易溶解于水,为避免产生倒吸现象,导管c不能插入到水中,反应结束后,在锥形瓶内滴加硝酸银溶液会有淡黄色沉淀生成,可证明苯和液溴发生的是取代反应,另外还考查了反应后液体混合物的分离提纯,主要采用分液和蒸馏操作,据此解答;
(1)苯与液溴反应在铁粉作催化剂的作用下发生取代反应生成溴苯和溴化氢;
(2)因反应物易挥发,为提高原料利用率,长直导管除导气外,还起冷凝回流作用;
(3)溴化氢极易溶于水,可从安全操作考虑;
(4)加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应;
(5)反应完毕后,因有液溴过量,溶解在溴苯里,观察到烧杯底部有褐色不溶于水的液体,为除去溴苯溶有的溴和少量溴化氢,可选择NaOH溶液,溴苯是无色液体,密度比水大,因苯和溴苯相互混溶,可根据沸点差异选择分离操作;
(6)有尾气处理和利用冷凝管冷凝回流装置.
解答 解:(1)苯与液溴反应生成溴苯,化学方程式为 ,故答案为:
,故答案为: ;
;
(2)长导管起冷凝回流,也起导气作用,故答案为:导气;冷凝回流;
(3)溴化氢极易溶于水,插入水中可发生倒吸,故答案为:不能,因为生成的溴化氢极易溶于水,造成锥形瓶内的液体倒吸入烧瓶;
(4)反应生成了溴化氢溶于水中电离出溴离子和银离子,加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应,故答案为:取代反应;
(5)烧杯底部有褐色不溶于水的液体是因为溴苯里溶解了液溴的缘故,选择用氢氧化钠溶液除去溴苯里混有的溴和溴化氢,本身溴苯是无色的,密度比水大,可选择蒸馏的方法分离溴苯和苯的混合物,故答案为:多余的液溴溶于溴苯;NaOH溶液;无;重;蒸馏;
(6)图2有尾气处理和利用冷凝管充分冷凝回流装置,故答案为:有尾气处理;充分冷凝回流.
点评 本题主要考查了苯的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,难度不大.

 备战中考寒假系列答案
备战中考寒假系列答案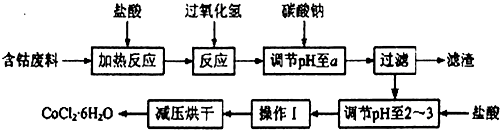
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,)
| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
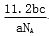 L B.
L B.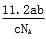 L
L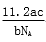 L D.
L D. L
L

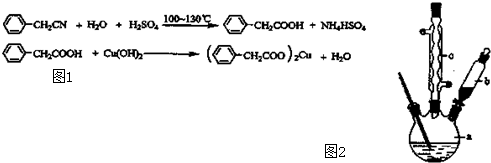
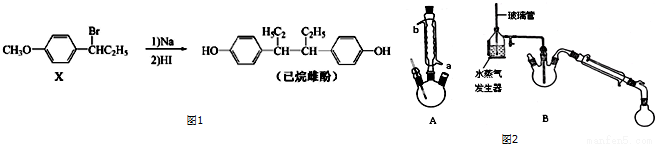
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: