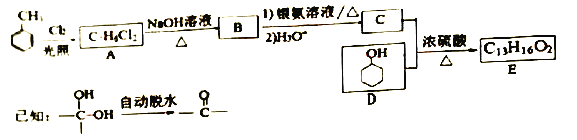
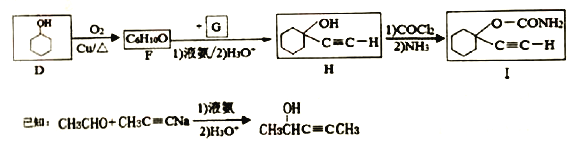
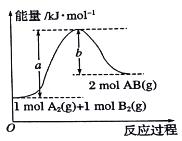
题目内容
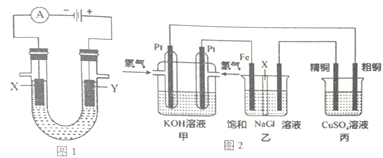
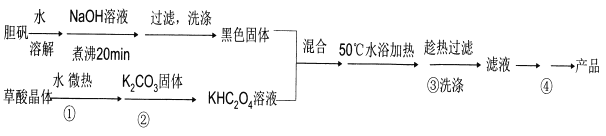
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
【答案】Ba(OH)2 K2CO3 稀盐酸为了除尽Mg2+、SO![]() MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓为了除尽过量的Ba2+Ba(OH)2+K2CO3===2KOH+BaCO3↓,BaCl2+K2CO3===BaCO3↓+2KCl
MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓为了除尽过量的Ba2+Ba(OH)2+K2CO3===2KOH+BaCO3↓,BaCl2+K2CO3===BaCO3↓+2KCl
【解析】
试题除去KCl溶液中少量的MgCl2、MgSO4,为防止引入杂质,Na2CO3和Ba(NO3)2是不能使用的。应先加入稍过量的Ba(OH)2,把MgCl2和MgSO4完全沉淀,然后再加入稍过量的K2CO3除去过量的Ba(OH)2,过滤后,向滤液中加入稀盐酸除去过量的K2CO3。
(1)3种试剂的化学式:A、Ba(OH)2,B、K2CO3,C、稀盐酸。
(2)加过量Ba(OH)2的原因是为了除尽Mg2+、SO42-,有关反应的化学方程式MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓、MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓。
(3)加过量K2CO3的原因是为了除尽过量的Ba2+,有关反应的化学方程式为Ba(OH)2+K2CO3=2KOH+BaCO3↓、BaCl2+K2CO3===BaCO3↓+2KCl

 阅读快车系列答案
阅读快车系列答案