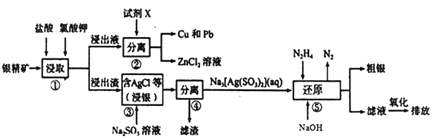
题目内容
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备NaN3
水合肼(N2H4·H2O) 与亚硝酸甲酯(CH3ONO)在氢氧化钠存在下制备NaN3,其反应装置如图所示:
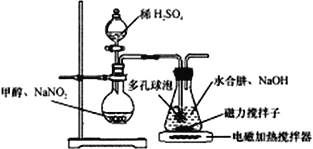
已知:2CH3OH+2NaNO2+H2SO4→2CH3ONO+ Na2SO4+2H2O; NaN3无色无味,微溶于醇、溶于水
(1)N2H4的电子式为_______________;NaN3晶体中阴离子与阳离子个数比为______________。
(2)装置中多孔球泡的作用是___________________。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,写出该反应的化学方程式_______________________________。
Ⅱ.回收甲醇
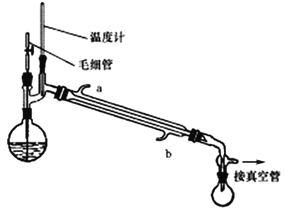
将制备反应后所得混合溶液加入烧瓶中,按照下图所示装置进行减压蒸馏。
已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
NaN3在40℃时分解
(4)实验时冷凝管中冷却水要“b进a出”原因是______________________。
(5)甲醇回收时需用减压蒸馏的原因是________________________。
(6)下列有关毛细管的作用说法正确的是_______________。
A.平衡圆底烧瓶内外压 B.作为气化中心,使蒸馏平稳
C.避免液体过热而暴沸 D.冷凝回流作用
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得NaN3湿品;再用去离子水重结晶得NaN3产品并用碘量法测定产品纯度。取产品6.50g加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入20.00mL 1.00mol·L-lKMnO4溶液,溶液呈紫红色;再加入足量KI溶液消耗过量的KMnO4溶液;其后用0.100mol·L-lNa2S2O3标准溶液滴定所产生的I2,消耗Na2S2O3溶液30.00mL。
(7)实验所得产品的纯度为______________________。
已知:①产品中杂质不参与反应;
②测定过程中发生的反应:
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。
【答案】 ![]() 1∶1 使CH3ONO气体与溶液充分接触(其他合理答案均可,如增大CH3ONO蒸汽与反应液接触面积,加快反应速率或使反应物能够充分反应等) N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O 冷凝水从下口进上口出,使冷水与甲醇蒸气的接触面积大,上下对流,接触时间长,提高冷凝效果。 甲醇的沸点为64.7℃,而NaN3在40℃时分解,因此蒸馏甲醇时需要降低甲醇的沸点,采用减压蒸馏 BC 97.00%
1∶1 使CH3ONO气体与溶液充分接触(其他合理答案均可,如增大CH3ONO蒸汽与反应液接触面积,加快反应速率或使反应物能够充分反应等) N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O 冷凝水从下口进上口出,使冷水与甲醇蒸气的接触面积大,上下对流,接触时间长,提高冷凝效果。 甲醇的沸点为64.7℃,而NaN3在40℃时分解,因此蒸馏甲醇时需要降低甲醇的沸点,采用减压蒸馏 BC 97.00%
【解析】Ⅰ.(1)氮原子与氢原子之间形成单键,氮原子之间形成单键,因此N2H4的电子式为![]() ;NaN3晶体中阳离子为Na+、阴离子为N3-,阴离子与阳离子个数比为1:1,正确答案:
;NaN3晶体中阳离子为Na+、阴离子为N3-,阴离子与阳离子个数比为1:1,正确答案:![]() ;1:1。
;1:1。
(2)装置中多孔球泡的作用是使CH3ONO气体与溶液充分接触,正确答案:使CH3ONO气体与溶液充分接触(其他合理答案均可,如增大CH3ONO蒸汽与反应液接触面积,加快反应速率或使反应物能够充分反应等)。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,反应的化学方程式N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O ;正确答案:N2H4·H2O+CH3ONO+NaOH==NaN3+CH3OH+3H2O。
Ⅱ. (4)实验时冷凝管中冷却水要“b进a出”原因是冷凝水从下口进上口出,使冷水与甲醇蒸气的接触面积大,上下对流,接触时间长,提高冷凝效果,正确答案: 冷凝水从下口进上口出,使冷水与甲醇蒸气的接触面积大,上下对流,接触时间长,提高冷凝效果。
(5)根据题给信息可知, 甲醇的沸点为64.7℃,而NaN3在40℃时分解,因此蒸馏甲醇时需要降低甲醇的沸点,采用减压蒸馏 ;正确答案:甲醇的沸点为64.7℃,而NaN3在40℃时分解,因此蒸馏甲醇时需要降低甲醇的沸点,采用减压蒸馏。
(6)该装置用到了毛细管,它的主要作用为作为气化中心,使蒸馏平稳,避免液体过热而暴沸,不能起到冷凝回流、平衡圆底烧瓶内外压的作用,BC正确;正确答案 BC。
Ⅲ.根据测定过程中发生的反应可知
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。
设反应剩余的KMnO4的量为xmol,物质之间的关系为2Na2S2O3~I2~2/5 KMnO4, 2/0.4=0.1×0.03/x,x=6×10-4mol,则参与氧化NaN3的KMnO4的量为0.02×1-6×10-4 mol,设参加反应NaN3有ymol,根据反应关系可知:10NaN3~2KMnO4,10/2=y/(0.02×1-6×10-4),解之得y=0.097mol,实验所得产品的纯度为0.097×65/6.5×100%=97.00%,正确答案:97.00%。