题目内容
对水的电离平衡不产生影响的粒子是( )
| A.HCl? | B.26M3+ |
C. | D.CH3COO- |
C
解析

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A.x=10-2y | B.x >y | C.x=y | D.x=102y |
下列说法正确的是
| A.常温下某溶液中由水电离出的c(H+)=1×10-amol/L,若a<7时,则该溶液可能为NaHSO4溶液 |
| B.中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和1×10-4 mol·L-1 K2Cr04溶液混合,会有Ag2CrO4沉淀产生 |
室温下,下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是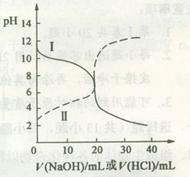
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则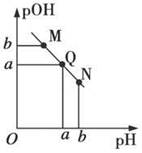
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)>c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
A.c(SO )>c(NH )>c(NH )>c(Fe2+)>c(H+)>c(OH-) )>c(Fe2+)>c(H+)>c(OH-) |
B.c(SO )=c(NH )=c(NH )>c(Fe2+)>c(H+)>c(OH-) )>c(Fe2+)>c(H+)>c(OH-) |
C.2c(SO )+c(OH-)=c(NH )+c(OH-)=c(NH )+2c(Fe2+)+c(H+) )+2c(Fe2+)+c(H+) |
D.c(NH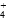 )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2] )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2] |
已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |