题目内容
室温下,下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
C
解析试题分析:A、醋酸中的c(H+)=10-5mol/L,所以c(OH-)=10-9 mol/L则水电离出的c(H+)为10-9 mol/L,而pH=5的NH4Cl溶液显酸性,是因为铵根离子的水解,pH=5意味着水电离产生的c(H+)=10-5mol/L,错误;B、pH=3的醋酸中c(H+)=1×10-3 mol/L,而c(CH3COOH)>1×10-3 mol/L,pH=11的NaOH溶液c(OH-)=1×10-3 mol/L=c(NaOH)<c(CH3COOH),所以等体积混合,醋酸过量,溶液显酸性,pH<7,错误;C、一水合氨是弱碱,稀释过程中会促进其电离产生氢氧根离子,所以氨水中的氢氧根离子浓度大于氢氧化钠溶液中的氢氧根离子浓度,正确;D、不符合电荷守恒,应为c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),错误,答案选C。
考点:考查溶液中水电离的氢离子、氢氧根离子浓度的计算,酸、碱混合计算,溶液稀释,电荷守恒规律的应用

 阅读快车系列答案
阅读快车系列答案某浓度的氨水中存在下列平衡:NH3·H2O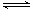 NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A.适当升高温度 | B.加入水 | C.通入NH3 | D.加入少量盐酸 |
FeCl3的水解方程式可写为FeCl3+3H2O  Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
| A.降低温度 | B.加入少量Na2CO3 | C.加入少量盐酸 | D.增加FeCl3的浓度 |
下列解释实验事实的平衡不正确的是
| | 实 验 | 解释 |
| A | 100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 | H2O H+ + OH- H+ + OH- |
| B | 0.1 mol/L CH3COOH的pH=3 | CH3COOH CH3COO- + H+ CH3COO- + H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3+ + 3OH- Fe(OH)3 Fe(OH)3 |
| D | 用稀硫酸洗涤BaSO4,沉淀损失小 | BaSO4(s)  Ba2+(aq) + SO42-(aq) Ba2+(aq) + SO42-(aq) |
对水的电离平衡不产生影响的粒子是( )
| A.HCl? | B.26M3+ |
C.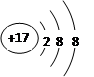 | D.CH3COO- |
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
| A.只有AgBr沉淀生成 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主 |
| D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主 |
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
| A.BaSO4的溶度积常数比BaCO3的小 |
| B.S没有毒性,C有毒性 |
| C.BaSO4的密度大 |
| D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
| A.将水加热,平衡正向移动,KW变小 |
| B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大 |
| C.新制氯水久置后,水的电离平衡正向移动,c(OH-)增大 |
| D.向水中加入少量CH3COONa固体,平衡正向移动,KW增大 |