题目内容
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则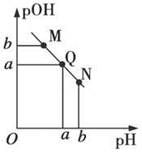
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)>c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
C
解析

练习册系列答案
相关题目
常温时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3) |
| B.pH=2的醋酸中:c(H+)=0.02mol?L-1 |
| C.0.1 mol?L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+) |
| D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+) |
某浓度的氨水中存在下列平衡:NH3·H2O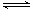 NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A.适当升高温度 | B.加入水 | C.通入NH3 | D.加入少量盐酸 |
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
C.c1<0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
现有室温下的四种溶液,有关叙述不正确的是
| 编号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积的③、④溶液分别与NaOH完全反应,消耗NaOH的物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中:c(Cl-)>c(
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)D.Va L④溶液与Vb L②溶液混合[近似认为混合溶液体积=(Va+Vb)L],若混合后溶液的pH=4,则Va∶Vb=11∶9
25 ℃时,5种银盐的溶度积常数(Ksp)分别是:
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
对水的电离平衡不产生影响的粒子是( )
| A.HCl? | B.26M3+ |
C.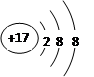 | D.CH3COO- |
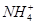 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c(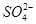 )
) )=c(
)=c(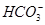 )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)