题目内容
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是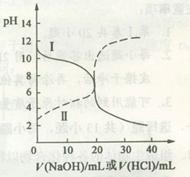
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
D
解析试题分析:A、曲线I滴定前溶液的pH大于7,为盐酸滴定氨水,当滴加溶液到10 mL时,溶液中含有等浓度的NH3?H2O和NH4Cl,不含CH3COO?,错误;曲线I中滴加溶液到25 mL时,溶液含NH4Cl和少量的HCl,离子浓度大小顺序为:c(C1-) > c(NH4+)>c(H+)>c(OH-),错误;C、曲线II滴定前溶液的pH小于7,为NaOH溶液滴定醋酸,溶液不存在NH4+和Cl?,错误;D、曲线II中滴加溶液到10mL时,溶液含有等浓度的CH3COOH和CH3COONa,根据电荷守恒可得:c(CH3COO?)+c(OH?)=c(Na+)+c(H+),根据物料守恒可得:c(CH3COOH)+c(CH3COO?)=2c(Na+),①式×2—②式可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],正确。
考点:本题考查酸碱中和滴定、离子浓度比较。

对水的电离平衡不产生影响的粒子是( )
| A.HCl? | B.26M3+ |
C.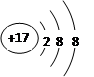 | D.CH3COO- |
已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
| A.BaSO4的溶度积常数比BaCO3的小 |
| B.S没有毒性,C有毒性 |
| C.BaSO4的密度大 |
| D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
| A.22.30 mL | B.22.35 mL | C.23.65 mL | D.23.70 mL |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
| A.CuS<Cu(OH)2<CuCO3 |
| B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS |
| D.Cu(OH)2<CuCO3<CuS |
室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
| A.将水加热,平衡正向移动,KW变小 |
| B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大 |
| C.新制氯水久置后,水的电离平衡正向移动,c(OH-)增大 |
| D.向水中加入少量CH3COONa固体,平衡正向移动,KW增大 |
在常温下,0.100 0 mol·L-1 Na2CO3溶液25 mL用0.100 0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )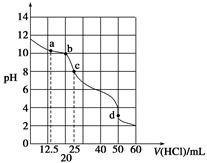
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |