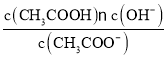题目内容
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
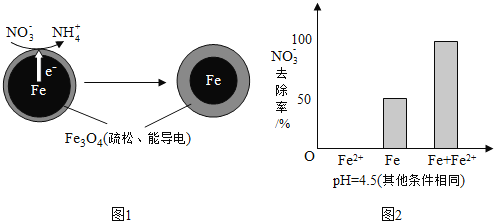
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
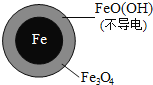
【答案】铁 ![]()
![]() 不导电,阻碍电子转移 本实验条件下,
不导电,阻碍电子转移 本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率
的去除率 ![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移 初始pH低时,产生的
,利于电子转移 初始pH低时,产生的![]() 充足;初始pH高时,产生的
充足;初始pH高时,产生的![]() 不足
不足
【解析】
(1)NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;(2)pH越高Fe3+越易水解生成FeO(OH);
(3)①根据图2中的三个实验结果进行分析;
②结合(2)题中的铁的最终物质形态结果差异进行分析;
(1) ①Fe还原水体中![]() ,则Fe作还原剂发生氧化反应,失去电子,作负极,
,则Fe作还原剂发生氧化反应,失去电子,作负极,
故答案为:铁;
![]() 在正极得电子发生还原反应产生
在正极得电子发生还原反应产生![]() ,根据图2信息可知为酸性环境,则正极的电极反应式为:
,根据图2信息可知为酸性环境,则正极的电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①加入![]() 可以显提高
可以显提高![]() 的去除率,pH越高,
的去除率,pH越高,![]() 越易水解生成
越易水解生成![]() ,而
,而![]() 不导电,阻碍电子转移,所以
不导电,阻碍电子转移,所以![]() 的去除率低,故答案为:
的去除率低,故答案为:![]() 不导电,阻碍电子转移;
不导电,阻碍电子转移;
(3)从图2的实验结果可以看出,单独加入![]() 时,
时,![]() 的去除率为0,因此得出
的去除率为0,因此得出![]() 不能直接还原
不能直接还原![]() ;而Fe和
;而Fe和![]() 共同加入时
共同加入时![]() 的去除率比单独Fe高,因此可以得出结论:本实验条件下,
的去除率比单独Fe高,因此可以得出结论:本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率,故答案为:本实验条件下,
的去除率,故答案为:本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率;
的去除率;
![]() 同位素示踪法证实了
同位素示踪法证实了![]() 能与
能与![]() 反应生成
反应生成![]() ,离子方程式为:
,离子方程式为:![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移,故答案为:
,利于电子转移,故答案为:![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移;
,利于电子转移;
(4)根据实验结果可知![]() 的作用是将不导电的
的作用是将不导电的![]() 转化为可导电的
转化为可导电的![]() ,而
,而![]() 的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响
的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响![]() 的含量,故答案为:初始pH低时,产生的
的含量,故答案为:初始pH低时,产生的![]() 充足;初始pH高时,产生的
充足;初始pH高时,产生的![]() 不足。
不足。

 习题精选系列答案
习题精选系列答案【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子