题目内容
下列说法错误的是
| A.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定 |
| B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 |
| C.决定化学反应速率的根本因素是参加反应的各物质的结构和性质 |
| D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
D
解析试题分析:A、由单质A转化为单质B,ΔH=+119kJ/mol,可知该转化是吸热反应,因此A的总能量低于B的总能量。能量越低越稳定,所以单质A比单质B稳定,A正确;B、灼热的碳与CO2反应既是氧化还原反应,又是吸热反应,因此又是生成物总能量高于反应物总能量的反应,B正确;C、决定化学反应速率的根本因素即内因是参加反应的各物质的结构和性质,C正确;D、对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,但V正增大的倍数小于V逆增大的倍数,从而使化学反应平衡逆向移动,D不正确,答案选D。
考点:考查反应热、物质稳定性以及外界条件对反应速率和平衡状态的影响

 阅读快车系列答案
阅读快车系列答案 反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为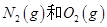 反应生成
反应生成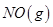 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是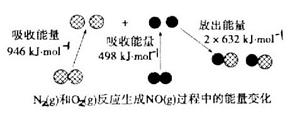
A.通常情况下,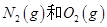 混合能直接生成NO 混合能直接生成NO |
B.1mol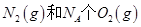 反应放出的能量为180kJ 反应放出的能量为180kJ |
| C.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
D.1mol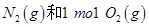 具有的总能量小于2mol 具有的总能量小于2mol 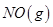 具有的总能量 具有的总能量 |
下列说法中正确的是
| A.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照条件下和点燃条件下的ΔH不同 |
| B.常温下,2A(s)+B(g)= 2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 |
| C.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热 |
| D.在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
节能减排成为社会发展过程中不可回避的问题。下列说法正确的是
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能等都属于可再生能源。
⑤乙醇属于一级能源
| A.①②⑤ | B.①②③ | C.③④ | D.①②③④ |
下列反应中的能量变化关系符合下图所示的是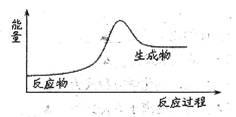
| A.盐酸与烧碱反应 | B.天然气燃烧 |
| C.三氧化硫与水反应 | D.煅烧石灰石 |
未来新能源的特点是资源丰富,使用时污染很小,可再生。下列符合未来新能源标准的是:①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
| A.①②③④ | B.④⑤⑥⑦ | C.③⑤⑥⑦ | D.③④⑤⑥⑦ |
温家宝总理在2010年政府工作报告中提出,推广高效节能技术,提倡低碳生活,积极发展新能源和可再生能源。下列有关做法与此不相符的是( )
| A.大力开发丰富的煤炭资源,减少对石油的依赖 |
| B.在西部和沿海地区兴建风力发电站,解决能源问题 |
| C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
如图所示是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( ) 
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |