题目内容
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =________________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=________________________(MPa)2
【答案】ΔH1+2ΔH2 2.8 > > B 66.7% 0.01
【解析】
根据盖斯定律、化合价变化、平衡移动原理、化学平衡状态的特征进行相关的分析,要注意结合图像中的信息。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s)
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g)
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
①+②2可得③,由盖斯定律可知,则ΔH3 =ΔH1+2ΔH2。在反应③中只有O2是氧化剂,O元素从0价降到-2价,电子转移的数目为28e-,若有0.2mol MoS2参加反应,则转移电子2.8mol。
(2)①由图可知,在相同的压强下,反应物氢气的体积分数随温度的升高而减小,故该反应为吸热反应,该反应的ΔH>0;该反应为气体分子数增大的反应,在相同温度下,压强越小,氢气的转化率越大,则氢气的体积分数越小,故P2>0.1MPa。
②A.v正(H2)=v逆(H2O),能表示正反应速率和逆反应速率相等,A正确;
B.再加入MoS2不能改变其浓度,故不能使平衡发生移动,则H2转化率不变,B不正确;
C.反应前后的气体分子数不等,故当容器内气体的密度不变时,一定达平衡状态,C正确;
D. 反应前后的气体分子数不等,容器内压强不变时,一定达平衡状态
综上所述,说法错误的是B。
③由图可知M点时氢气的体积分数为25%,设氢气的起始量为4mol,转化率为α,则氢氢气的变化量为4αmol,CO和H2O的变化量分别为2αmol和4αmol,三者的平衡量分别为(4-4α)mol、2αmol和4αmol,则有![]() ,解之得α=
,解之得α=![]() ,故平衡转化率为66.7%。
,故平衡转化率为66.7%。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。M点的压强为0.1MPa,平衡混合物中,H2(g)、CO(g)、H2O(g)的体积分数分别为0.25、0.25、0.5,M点的平衡常数Kp=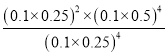 (MPa)2=0.01(MPa)2。
(MPa)2=0.01(MPa)2。

 阅读快车系列答案
阅读快车系列答案




