题目内容
【题目】若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为_________。1克CH4完全燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量。写出表示CH4燃烧热的热化学方程式___________
【答案】N2(g)+2O2(g)=2NO2(g) △ H=+67.8 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(l) △ H=-16Q kJ/mol
【解析】
23 g NO2的物质的量为![]() =0.5mol,由题意可知适量的N2和O2完全反应生成2mol NO2的需要吸收的热量为
=0.5mol,由题意可知适量的N2和O2完全反应生成2mol NO2的需要吸收的热量为![]() =67.8kJ,则热化学方程式为N2(g)+2O2(g)=2NO2(g) △ H=+67.8 kJ/mol;1克CH4的物质的量为
=67.8kJ,则热化学方程式为N2(g)+2O2(g)=2NO2(g) △ H=+67.8 kJ/mol;1克CH4的物质的量为![]() =
=![]() mol,则1mol CH4完全燃烧生成CO2(g)和H2O(l)放出的热量为
mol,则1mol CH4完全燃烧生成CO2(g)和H2O(l)放出的热量为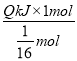 =16QkJ,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-16QkJ/mol,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+67.8 kJ/mol;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-16Q kJ/mol。
=16QkJ,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-16QkJ/mol,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+67.8 kJ/mol;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-16Q kJ/mol。

练习册系列答案
相关题目