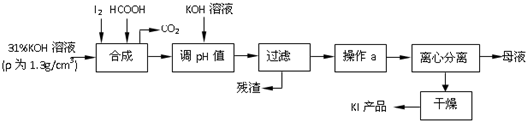
题目内容
7.将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:| N2(mol•L-1) | H2(mol•L-1) | NH3(mol•L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
(1)用H2表示该反应2s内的平均反应速率为0.6 mol•L-1•s-1.
(2)不能(填“能”或“不能”)确认该反应2s末已达化学平衡状态.
分析 (1)图表中2s内氢气浓度变化=3mol/L-1.8mol/L=1.2mol/L,根据反应速率V=$\frac{△c}{△t}$来计算;
(2)根据化学平衡状态的标志可知,正逆反应速率相同、各组分含量保持不变时反应达到平衡,2s末无法判断反应是否达到平衡状态.
解答 解:(1)用H2表示该反应2s内的平均反应速率为,V(H2)=$\frac{△c}{△t}$=$\frac{3mol/L-1.8mol/L}{2s}$=$\frac{1.2mol/L}{2s}$=0.6 mol•L-1•s-1,故答案为:0.6 mol•L-1•s-1;
(2)因无化学平衡状态的标志,所以不能确认该反应2s末已达化学平衡状态,故答案为:不能.
点评 本题主要考查了反应速率的计算,平衡状态判断依据,难度不大,把握平衡的判断方法及表格中数据分析为解答的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.已知某温度下,Ka(HCN)=6.2×10-10 mol•L-1、Ka(HF)=6.8×10-4 mol•L-1、Ka(CH3COOH)=1.8×10-5 mol•L-1、Ka(HNO2)=6.4×10-6mol•L-1.物质的量浓度都为0.1mol•L-1的下列溶液中,酸性最弱的是( )
| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
18.区别CH4和C2H4的方法最好是( )
| A. | 通入溴水中观察溶液颜色的变化 | B. | 嗅闻它们的气味 | ||
| C. | 比较它们在水中的溶解度大小 | D. | 点燃它们后,观察火焰 |
15.下列气体中,有颜色的是( )
| A. | 氮气 | B. | 氯气 | C. | 二氧化碳 | D. | 二氧化硫 |
2.下列有关反应速率的说法正确的是( )
| A. | 用铁片和稀硫酸反应制氢气时,滴入几滴硫酸铜溶液可以加快反应速率 | |
| B. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
12.下列化学用语正确的是( )
| A. | 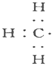 --甲基的电子式 --甲基的电子式 | B. | 甲烷的结构式:CH4 | ||
| C. | CH3-CH=CH-CH3的键线式: | D. | 苯的分子式: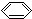 |
19.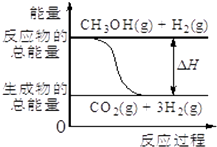 已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g),该反应中的能量变化如图所示下列说法不正确的是( )
已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g),该反应中的能量变化如图所示下列说法不正确的是( )
 已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g),该反应中的能量变化如图所示下列说法不正确的是( )
已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g),该反应中的能量变化如图所示下列说法不正确的是( )| A. | 该反应拆开反应物所有键所吸收的总能量小于形成生成物所放出的总能量 | |
| B. | 该反应是放热反应 | |
| C. | 该反应不能设计成原电池 | |
| D. | 该反应所有分子中各原子都以共价键相结合? |
16.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | C3H6 | C. | C3H8 | D. | C2H6O |