题目内容
17.已知某温度下,Ka(HCN)=6.2×10-10 mol•L-1、Ka(HF)=6.8×10-4 mol•L-1、Ka(CH3COOH)=1.8×10-5 mol•L-1、Ka(HNO2)=6.4×10-6mol•L-1.物质的量浓度都为0.1mol•L-1的下列溶液中,酸性最弱的是( )| A. | HCN | B. | HF | C. | CH3COOH | D. | HNO2 |
分析 电离平衡常数越小,酸性越弱,其溶液的pH越大,以此来解答.
解答 解:Ka(HCN)=6.2×10-10mol•L-1、Ka(HF)=6.8×10-4mol•L-1、Ka(CH3COOH)=1.8×10-5mol•L-1、Ka(HNO2)=6.4×10-6mol•L-1,
则物质的量浓度都为0.1mol•L-1的溶液,电离平衡常数越小,酸性越弱,则酸性最弱的是HCN,
故选A.
点评 本题考查了弱电解质的电离,为高频考点,明确酸的电离平衡常数与酸性强弱的关系是解本题关键,难度不大.

练习册系列答案
相关题目
8.Na2O2晶体中含有的化学键有( )
| A. | 离子键、σ键 | B. | 极性键、离子键 | C. | 离子键 | D. | 离子键、π键 |
5.下列化学反应中,属于氧化还原反应的是( )
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | NH3+HCl=NH4Cl | ||
| C. | 2Fe(OH)3$\frac{\underline{\;加热\;}}{\;}$Fe2O3+3H2O | D. | NaOH+HNO3=NaNO3+H2O |
12.元素性质随原子序数的递增呈周期性变化的本质是( )
| A. | 原子核外电子排布呈现周期性变化 | |
| B. | 原子的电子层数增多 | |
| C. | 元素的相对原子质量逐渐增大,量变引起质变 | |
| D. | 原子半径呈周期性变化 |
2.某种烃与H2 1:1加成后的产物是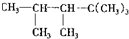 则该烃的结构式可能有则该烯烃的结构( )
则该烃的结构式可能有则该烯烃的结构( )
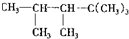 则该烃的结构式可能有则该烯烃的结构( )
则该烃的结构式可能有则该烯烃的结构( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
9.人们在研究金星大气成分时发现金星大气中有一种称为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列有关COS的推测不正确的是( )
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS的电子式为: | |
| C. | COS的分子中所有原子满足8电子稳定结构 | |
| D. | COS分子中三个原子处于同一直线上 |
6.二甲苯的苯环上有一个氢原子被溴取代后的一溴代物有六种异构体,它们的熔点分别如下表所示.下列叙述正确的是( )
| 二甲苯一溴代物的熔点(℃) | 234 | 206 | 214 | 204 | 212 | 205 |
| 对应的二甲苯的熔点(℃) | 13 | -48 | -25 | -48 | -25 | -48 |
| A. | 点为234℃的是一溴代间二甲苯 | B. | 熔点为234℃的是一溴代邻二甲苯 | ||
| C. | 熔点为-48℃的是间二甲苯 | D. | 熔点为-25℃的是对二甲苯 |
7.将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
根据以上相关数据回答问题:
(1)用H2表示该反应2s内的平均反应速率为0.6 mol•L-1•s-1.
(2)不能(填“能”或“不能”)确认该反应2s末已达化学平衡状态.
| N2(mol•L-1) | H2(mol•L-1) | NH3(mol•L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
(1)用H2表示该反应2s内的平均反应速率为0.6 mol•L-1•s-1.
(2)不能(填“能”或“不能”)确认该反应2s末已达化学平衡状态.