题目内容
【题目】钛合金材料在航海航天等工业有十分重要的用途。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图所示。

请回答下列问题:
(1)步骤①发生氧化还原反应,其氧化剂是___________。
(2)步骤②中发生的化学反应方程式为____________________________________________。
(3)步骤③需在氩气环境中进行,目的是__________________________________________。
(4)金属钛中常混有少量镁,提纯时可用稀硫酸除去少量的镁,其理由是___________________________________________________________。
【答案】FeO ![]() 防止钛、镁在高温下被空气氧化(或防止金属被空气氧化) 钛(Ti)常温下与酸、碱均不反应,镁能与稀硫酸反应(回答合理可给分)
防止钛、镁在高温下被空气氧化(或防止金属被空气氧化) 钛(Ti)常温下与酸、碱均不反应,镁能与稀硫酸反应(回答合理可给分)
【解析】
根据流程图可知,钛铁矿(主要成分是FeO和TiO2),与C在高温下发生氧化还原反应,生成Fe,说明C只还原了FeO。TiO2在高温下与C和Cl2反应,生成TiCl4,然后加Mg高温还原,得到Ti单质。
(1)根据分析,步骤①中C还原了FeO,FeO是氧化剂;
(2)步骤②反应物为TiO2、C、Cl2,生成物为TiCl4,C被氧化成CO,发生的化学反应方程式为![]() ;
;
(3)由于Ti和Mg都是金属,高温下容易被空气氧化,所以在氩气环境中进行可以防止Ti、Mg在高温下被空气氧化;
(4)由于钛(Ti)常温下与酸、碱均不反应,加入的稀硫酸只与Mg反应,反应后可以过滤除去含有Mg的溶液。

【题目】(12分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________(写出一种)。
【题目】下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | _____ | _____ | _____ | _____ |
①CH(CH3)3和CH3CH2CH(CH3)2
②C(CH3)4和CH3CH2CH(CH3)2
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥12C、13C、14C
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑧臭氧(18O3)和氧气(16O18O )
⑨ 和
和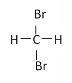
⑩ H216O和H218O
【题目】下表是元素周期表的一部分,表中的每个字母代表一种元素,请根据要求回答问题。
族 周期 | ⅠA | 0 | |||||||
1 | a | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | b | c | d | ||||||
3 | e | f | g |
(1)元素g在元素周期表的位置为____________________。
(2)b和g两种元素的原子半径大小关系:b______g(填“>”或“<”).
(3)由原子个数比为1:1:1的a、b、c三种元素组成的共价化合物X,共形成4对共用电子对,则X的结构式为______________。
(4)f的最高价氧化物与e的最高价氧化物对应的水化物在溶液中反应的离子方程式为_________________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
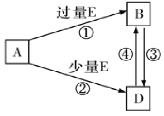
①E的电子式为_______________,B的化学式为____________________。
②A中的化学键类型为____________________
③自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mo/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为___________g。