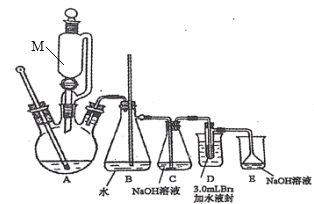
题目内容
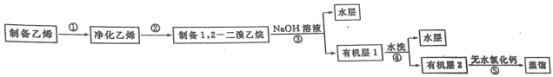
【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
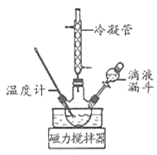
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
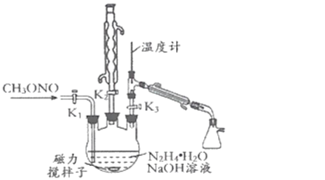
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL
【答案】防止过量的NaClO溶液将水合肼氧化 ![]() CO(NH2)2+ClO-+2OH-
CO(NH2)2+ClO-+2OH-![]() N2H4·H2O+Cl-+CO32- 20℃水浴 关闭K1、K2,打开K3 CH3ONO+N2H4·H2O+NaOH=NaN3+CH3OH+3H2O 蒸发浓缩、冷却结晶 真空或隔绝空气 100
N2H4·H2O+Cl-+CO32- 20℃水浴 关闭K1、K2,打开K3 CH3ONO+N2H4·H2O+NaOH=NaN3+CH3OH+3H2O 蒸发浓缩、冷却结晶 真空或隔绝空气 100
【解析】
(1) NaClO在碱性条件下把CO(NH2)2氧化为N2H4H2O,根据电子守恒配平离子方程式;
(2)①水浴加热便于控制温度;右侧为蒸馏装置;②亚硝酸甲酯与水合肼在碱性条件下反应生成叠氮化钠、甲醇和水;
(3) 叠氮化钠溶液蒸发浓缩、冷却结晶可获得叠氮化钠晶体;
(4)叠氮化钠常使用次氯酸钠溶液处理,根据氮元素化合价高,氯元素化合价降低,二者反应可生成无毒的气体N2,则氯只能从+1降到-1价,根据电子守恒,反应方程式是2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH;
(1)在碱性条件下NaClO把CO(NH2)2氧化为N2H4H2O,由于水合肼具有强还原性,为防止过量的NaClO溶液将水合肼氧化,实验中要缓慢滴加NaClO溶液;N2H4 的结构式为![]() ,根据得失电子守恒,该反应的离子方程式是CO(NH2)2+ClO-+2OH-
,根据得失电子守恒,该反应的离子方程式是CO(NH2)2+ClO-+2OH-![]() N2H4·H2O+Cl-+CO32-;
N2H4·H2O+Cl-+CO32-;
(2)①水浴加热便于控制温度,温度在20℃左右反应的转化率最高,所以采用20℃水浴加热;右侧为蒸馏装置,溶液蒸馏前,关闭K1、K2,打开K3;
②亚硝酸甲酯与水合肼在碱性条件下反应生成叠氮化钠、甲醇和水,反应方程式是CH3ONO+N2H4·H2O+NaOH=NaN3+CH3OH+3H2O;
(3) 叠氮化钠溶液获得叠氮化钠晶体实验步骤为蒸发浓缩、冷却结晶,减压过滤,晶体用乙醇洗涤23次后,再在真空或隔绝空气干燥;
(4)设需要0.5mol L的NaClO溶液VmL;
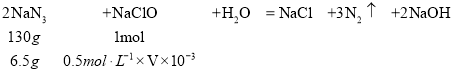
V=100;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
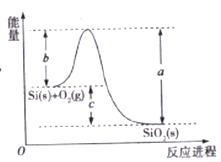
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。