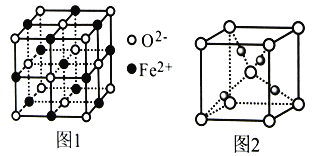
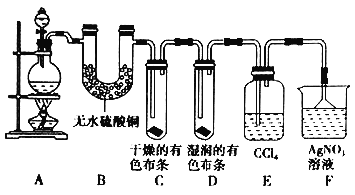
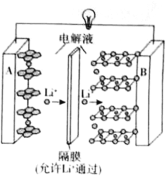
题目内容
【题目】在密闭容器中的一定量混合气体发生反应xM (g)+yN(g)![]() zP(g)。平衡时测得M的浓度为0.80 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0.50 mol/L。下列有关判断正确的是
zP(g)。平衡时测得M的浓度为0.80 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0.50 mol/L。下列有关判断正确的是
A.x + y < zB.平衡向正反应方向移动
C.N的转化率降低D.混合气体的密度不变
【答案】C
【解析】
平衡时测得M的浓度为0.80mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,M的浓度变为0.40mol/L,而再达平衡时,测得M的浓度降低为0.50mol/L,由此可知容器容积增大,压强减小,平衡逆向移动了,据此解答。
平衡时测得M的浓度为0.80mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,M的浓度变为0.40mol/L,而再达平衡时,测得M的浓度降低为0.50mol/L,由此可知容器容积增大,压强减小,平衡逆向移动了,
A. 减小压强,平衡逆向移动,而减压平衡向气体体积增大的方向移动,则x+y > z,A项错误;
B. 由上述分析可知平衡逆向移动,B项错误;
C. 平衡逆向移动,N的转化率降低,C项正确;
D. 根据质量守恒定律知混合气体的质量不变,体积增大,则混合气体的密度减小,D项错误;
答案选C。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
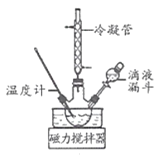
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
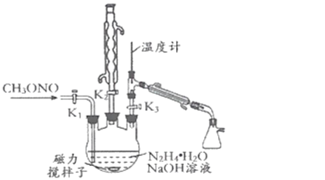
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL