题目内容
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的四种短周期主族元素,常见单质分子
是原子序数依次增大的四种短周期主族元素,常见单质分子![]() 中含有3对共用电子对,由
中含有3对共用电子对,由![]() 、
、![]() 形成的一种气态化合物不能稳定地存在于空气中,
形成的一种气态化合物不能稳定地存在于空气中,![]() 、
、![]() 同周期且
同周期且![]() 的最高正价是
的最高正价是![]() 的7倍。下列说法正确的是( )。
的7倍。下列说法正确的是( )。
A.含氧酸的酸性:![]()
B.简单离子半径:![]()
C.最简单氢化物的沸点:![]()
D.![]() 与
与![]() 形成的化合物中只含有离子键
形成的化合物中只含有离子键
【答案】B
【解析】
![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的四种短周期主族元素,常见单质分子
是原子序数依次增大的四种短周期主族元素,常见单质分子![]() 中含有3对共用电子对,则X为N,由
中含有3对共用电子对,则X为N,由![]() 、
、![]() 形成的一种气态化合物不能稳定地存在于空气中,则Y为O,因为NO能被空气中氧气氧化,
形成的一种气态化合物不能稳定地存在于空气中,则Y为O,因为NO能被空气中氧气氧化,![]() 、
、![]() 同周期且
同周期且![]() 的最高正价是
的最高正价是![]() 的7倍,则Z为+1价钠,W是+7价Cl,据此答题;
的7倍,则Z为+1价钠,W是+7价Cl,据此答题;
A.W是Cl、X是N,氯的含氧酸有HClO4、HClO3、HClO2、HClO,氮的含氧酸有HNO3、HNO2,没有指明最高价氧化物的水化物,A错误;
B.四种离子中,氯离子半径最大,氮离子、氧离子和钠离子具有相同的电子层结构,核电荷数越大,离子半径越小,故简单离子半径:![]() ,B正确;
,B正确;
C. 最简单氢化物的沸点:氨气比氯化氢的高,因为氨分子间有氢键,C错误;
D. ![]() 与
与![]() 形成的化合物可以是氧化钠、过氧化钠,它们都有离子键,但过氧根离子内有共价键,D错误;
形成的化合物可以是氧化钠、过氧化钠,它们都有离子键,但过氧根离子内有共价键,D错误;
答案选B。

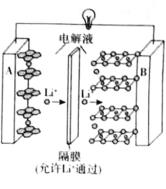
【题目】水合肼(N2H4H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。如图是工业水合肼法制备叠氮化钠的工艺流程。

查阅资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
Ⅰ.合成水合肼。实验室水合肼合成水合肼装置如图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
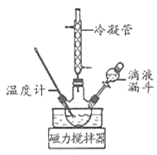
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO溶液的原因是_____;N2H4 的结构式为_____,制取N2H4H2O的离子方程式为_________。
II.制备叠氮化钠。实验室可利用如图所示的装置及药品制备叠氮化钠。
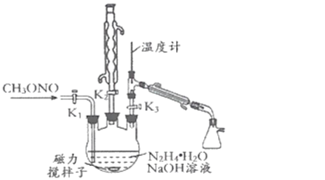
(2)①根据实验发现温度在20℃左右反应的转化率最高,但是该反应属于放热反应,因此 可釆取的措施是_____;流程中A溶液蒸馏前,图中装置中开关K1、K2、K3的合理 操作顺序是______。
②写出该方法制备叠氮化钠的化学方程式:_____。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为_____,减压过滤,晶体用乙醇洗涤23次后,再_____干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol L-1的NaClO溶液_____mL