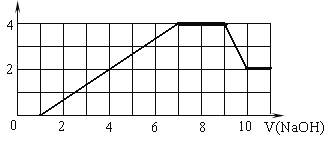
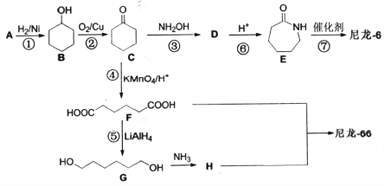
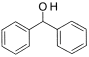
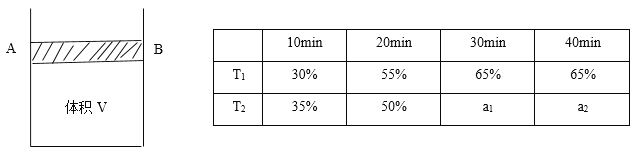
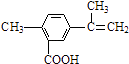
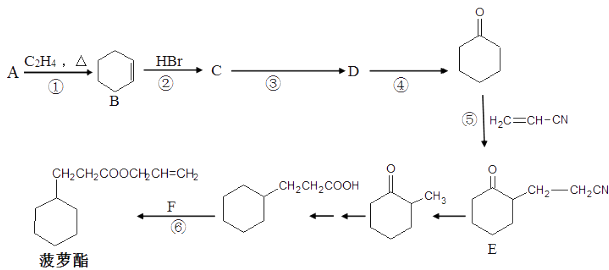
��Ŀ����
����Ŀ��A��B��C��D����Ԫ�أ�ԭ��������������Aԭ�ӵ����������4�����ӣ�B�������Ӻ�C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ����Ԫ�صĵ��ʷ�Ӧ������һ�ֵ���ɫ�Ĺ���E��D��L�����������K��M�������Ӳ��ϵĵ�����֮�ͣ�
��1��C���ӵĽṹʾ��ͼΪ �� D�����ڱ���λ�ã�
��2��A��D��Ԫ���γɵĻ�������������ӡ����ۡ��������
��3��д��E�ĵ���ʽ�� ��
��4��д��D������������ˮ�����A��Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��![]() ,�������ڵڢ�A��
,�������ڵڢ�A��
��2������
��3��![]()
��4��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O
CO2��+2SO2��+2H2O
���������⣺���ݷ�����֪��AΪ̼��BΪ����CΪ�ƣ�DΪ��
��1��CΪ�ƣ��������ʧȥ1�����ӱ�������ӣ������ӵ����ӽṹʾ��ͼΪ�� ![]() ��DΪS��S���ڵ������ڵڢ�A�壬
��DΪS��S���ڵ������ڵڢ�A�壬
���Դ��ǣ� ![]() ���������ڵڢ�A�壻
���������ڵڢ�A�壻
��2��C��S��Ԫ���γɵĻ�����Ϊ����̼�����ڹ��ۻ����
���Դ��ǣ����ۣ�
��3��EΪ�������ƣ�������������������������������Ӽ���������֮���γɷǼ��Թ��ۼ����������ʽΪ�� ![]() ��
��
���Դ��ǣ� ![]() ��
��
��4��S������������ˮ����Ϊ���ᣬŨ������C��Ӧ���ɶ�����̼�����������ˮ����Ӧ�Ļ�ѧ����ʽΪ��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O�����Դ��ǣ�C+2H2SO4��Ũ��
CO2��+2SO2��+2H2O�����Դ��ǣ�C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�